Chlorid platiničitý
| Chlorid platiničitý | |
|---|---|
 Struktura chloridu platiničitého | |
| Obecné | |
| Systematický název | Chlorid platiničitý |
| Anglický název | Platinum(IV) chloride |
| Německý název | Platin(IV)-chlorid |
| Sumární vzorec | PtCl4 |
| Vzhled | červenohnědý prášek |
| Identifikace | |
| Registrační číslo CAS | 13454-96-1 |
| PubChem | 26031 |
| SMILES | [Pt+4].[Cl-].[Cl-].[Cl-].[Cl-] |
| InChI | 1/4ClH.2Pt/h4*1H;;/q;;;;2*+2/p-4 |
| Vlastnosti | |
| Molární hmotnost | 336,89 g/mol |
| Teplota tání | 370 °C (rozklad) |
| Hustota | 4,303 g·cm−3 (bezvodý) 2,43 g·cm−3 (pentahydrát) |
| Rozpustnost ve vodě | 58,7 g/100 g (bezvodý) |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Chlorid platiničitý je chemická sloučenina se vzorcem PtCl4, je to červenohnědá pevná látka.[2]
Příprava a reakce
Chlorid platiničitý se připravuje nejčastěji zahříváním kyseliny hexachloroplatiničité, která se získává rozpouštěním platiny v lučavce královské:
- H2PtCl6 → PtCl4 + 2 HCl
Po odstranění nadbytku kyseliny krystaluje z roztoku chlorid platiničitý ve formě červených krystalů pentahydrátu PtCl4·5H2O,[3] který lze dehydratovat zahříváním na teplotu nad 300 °C v proudu suchého chloru. Pentahydrát je stabilní a slouží jako komerční forma PtCl4.[4]
Působením vodných roztoků hydroxidů vzniká hexahydroxoplatiničitý ion [Pt(OH)6]2−. Zahříváním uvolňuje chlor a vzniká chlorid platnatý:
- PtCl4 → PtCl2 + Cl2
Struktura
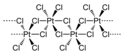
Chlorid platiničitý se skládá z oktaedrických jednotek PtCl6, které tvoří polymer. Polovina chloridů je můstkových a propojuje atomy platiny. Rozpouštění PtCl4 je možné pouze pokud dojde k přerušení můstkových vazeb Pt-Cl. Přídavkem HCl vzniká H2PtCl6. Známe i adukty typu cis-PtCl4L2, ty se ale nejčastěji připravují oxidací platnatých solí.
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Platinum(IV) chloride na anglické Wikipedii.
- ↑ a b Platinum tetrachloride. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ GREENWOOD, NORMAN NEILL. Chemie prvků. Sv. 1.. 1. vyd. vyd. Praha: Informatorium 793 s., 1 příl s. ISBN 8085427389, ISBN 9788085427387. OCLC 320245801 S. 1426–1428.
- ↑ NEWTH, George Samuel. A text-book of inorganic chemistry. Bombay: Longmans, Green, and co., 1920. 724 s. S. 694.
- ↑ HRSG. VON GEORG BRAUER. UNTER MITARB. VON M. BAUDLER. Handbuch der präparativen anorganischen Chemie / 3.. 3., umgearb. Aufl. vyd. Stuttgart: Enke XIV, Seite 1408 -2113 s. ISBN 3432878230, ISBN 9783432878232. OCLC 310719495 S. 1709.
Externí odkazy
 Obrázky, zvuky či videa k tématu Chlorid platiničitý na Wikimedia Commons
Obrázky, zvuky či videa k tématu Chlorid platiničitý na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for toxic substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.
Structural formula of polymeric platinum(IV) chloride, PtCl4, as found in the crystal structure.
Structure drawn in ChemBioDraw Ultra 12.0.Ball-and-stick model of part of the crystal structure of platinum(IV) chloride, PtCl4.
Colour code:
- Platinum, Pt: grey
- Chlorine, Cl: green
Crystal structure data from J. Chem. Soc., Chem. Commun. (1972) 270-271 and Z. anorg. allg. Chem. (1969) 369, 154–160.
Image generated in CrystalMaker 8.3.