Chlorid sirný
| Chlorid sirný | |
|---|---|
 strukturní vzorec | |
 kuličkový model molekuly | |
 kalotový model molekuly | |
| Obecné | |
| Systematický název | dichlordisulfan |
| Anglický název | disulfur dichloride |
| Německý název | Dischwefeldichlorid |
| Sumární vzorec | S2Cl2 |
| Vzhled | světle jantarová až žlutooranžová olejovitá kapalina |
| Identifikace | |
| Registrační číslo CAS | 10025-67-9 |
| SMILES | ClSSCl |
| InChI | InChI=1S/Cl2S2/c1-3-4-2 |
| Vlastnosti | |
| Molární hmotnost | 135,04 g/mol |
| Teplota tání | −80 °C (193 K) |
| Teplota varu | 137,11 °C (410,2 K) |
| Hustota | 1,688 g/cm3 |
| Index lomu | 1,658 |
| Rozpustnost ve vodě | rozklad za uvolnění HCl |
| Měrná magnetická susceptibilita | −4,61×105 μm3/g |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R14 R20 R25 R29 R35 R50 |
| S-věty | S1/2 S26 S36/37/39 S45 S61 |
| Teplota vzplanutí | 118,5 °C |
| Teplota vznícení | 234 °C |
Některá data mohou pocházet z datové položky. | |
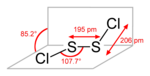
Chlorid sirný je anorganická sloučenina se vzorcem S2Cl2, jeden z chloridů síry. Jeho základní strukturní vzorec je Cl-S-S-Cl, úhel mezi rovinami vazeb Cl-S-S- je 90°. Tvar molekuly je podobný jako u H2O2. Dalším izomerem je S=SCl2, který se přechodně vytváří při vystavení S2Cl2 ultrafialovému záření.
Příprava a vlastnosti
Čistý chlorid sirný je žlutá kapalina, která na vzduchu tvoří dým díky reakci s vodou:
- 16 S2Cl2 + 16 H2O → 8 SO2 + 32 HCl + 3 S8
Vyrábí se částečnou chlorací elementární síry, reakce probíhá za pokojové teploty. V laboratoři se plynný chlor vede do baňky obsahující elementární síru, jakmile vznikne S2Cl2, obsah se změní na žlutou kapalinu:[2][3]
- S8 + 4 Cl2 → 4 S2Cl2 ΔH = −58,2 kJ/mol
Další přídavek chloru vytvoří chlorid sirnatý, který způsobí zabarvení do oranžovočervena:[3]
- S2Cl2 + Cl2 ↔ 2 SCl2 ΔH = −40,6 kJ/mol
Reakce je vratná a SCl2 postupně uvolňuje chlor za opětovného vzniku S2Cl2. Chlorid sirný může rozpustit velké množství síry za tvorby dichlorpolysulfanů:
- S2Cl2 + n S → S2+nCl2
Čistý chlorid sirný se získává destilací žlutooranžové kapaliny (směsi S2Cl2 a SCl2) nebo přidáním síry.
S2Cl2 také vzniká chlorací sirouhlíku při výrobě thiofosgenu.
Reakce
Chlorid sirný se hydrolyzuje na oxid siřičitý a elementární síru. Reakcí se sulfanem vznikají polysulfany, například:
- 2 H2S + S2Cl2 → H2S4 + 2 HCl
S2Cl2 reaguje s amoniakem za vzniku imidu heptasíry (S7NH) a podobných cyklických sloučenin S8−x(NH)x (x = 2, 3).
Použití
Chlorid sirný se používá k tvorbě vazeb C-S. Za přítomnosti AlCl3 reaguje s benzenem za vzniku difenylsulfidu:
- 8 S2Cl2 + 16 C6H6 → 8 (C6H5)2S + 16 HCl + S8
Aniliny reagují s S2Cl2 za přítomnosti NaOH Herzovou reakcí, přičemž vznikají ortho-aminothiofenoláty, tyto látky jsou prekurzory thioindigových barviv. S2Cl2 se také využívá na výrobu yperitu reakcí s ethylenem při 60 °C:
- 8 S2Cl2 + 16 C2H4 → 8 (ClC2H4)2S + S8
Další použití zahrnují výrobu sirných barviv, insekticidů a syntetických kaučuků. Tato látka se také používá na studenou vulkanizaci kaučuku, jako katalyzátor polymerace rostlinných olejů a na zvyšování tvrdosti dřeva.
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Disulfur dichloride na anglické Wikipedii.
- ↑ a b Sulfur monochloride. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ F. Fehér "Dichlorodisulfane" in Handbook of Preparative Inorganic Chemistry, 2nd Ed. Edited by G. Brauer, Academic Press, 1963, NY. Vol. 1. p. 371.
- ↑ a b GREENWOOD, Norman Neill; EARNSHAW, Alan. Chemie prvků. Sv. 2.. 1. vyd. vyd. Praha: Informatorium 13 s. S.794-1635 s. ISBN 80-85427-38-9, ISBN 978-80-85427-38-7. S. 847–848.
Externí odkazy
 Obrázky, zvuky či videa k tématu chlorid sirný na Wikimedia Commons
Obrázky, zvuky či videa k tématu chlorid sirný na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for toxic substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
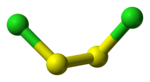
Ball-and-stick model of the disulfur dichloride molecule, S2Cl2
Structure, bonding and dimensions of the disulfur dichloride molecule, S2Cl2
Space-filling model of the disulfur dichloride molecule, S2Cl2










