Chlorid tantaličný
| Chlorid tantaličný | |
|---|---|
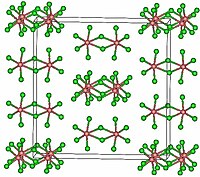
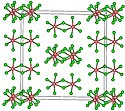
Krystalová struktura chloridu tantaličného | |
| Obecné | |
| Systematický název | Chlorid tantaličný |
| Anglický název | Tantalum(V) chloride |
| Německý název | Tantal(V)-chlorid |
| Sumární vzorec | TaCl5 |
| Vzhled | nažloutlá pevná látka |
| Identifikace | |
| Registrační číslo CAS | 7721-01-9 |
| PubChem | 24394 |
| SMILES | Cl[Ta](Cl)(Cl)(Cl)Cl |
| InChI | 1S/5ClH.Ta/h5*1H;/q;;;;;+5/p-5 |
| Vlastnosti | |
| Molární hmotnost | 358,213 g/mol |
| Teplota tání | 216 °C |
| Teplota varu | 239,4 °C (rozklad) |
| Hustota | 3,68 g.cm−3 |
| Rozpustnost ve vodě | hydrolyzuje |
Některá data mohou pocházet z datové položky. | |
Chlorid tantaličný, TaCl5, je nažloutlá pevná látka.[1] Je to výhodná výchozí látka pro přípravu jiných sloučenin tantalu.[2] V přítomnosti vody hydrolyzuje za vzniku TaOCl3 nebo až oxidu tantaličného (Ta2O5).[2] Proto je nutné s ním manipulovat v ochranné atmosféře.
Struktura
Krystaluje v monoklinické prostorové grupě C2/m.[3] Základní jednotkou je dvojice oktaedrů TaCl6 sdílejících hranu, atomy tantalu jsou propojeny chloridovými můstky.[2] Dimerní strukturu si zachovává i v roztoku s nekomplexujícími rozpouštědly a z velké části i v tavenině. V plynném skupenství je tvořen monomerem, ten má tvar trigonální bipyramidy.[1][2]
Fyzikální vlastnosti
Rozpustnost chloridu tantaličného mírně roste v sérii aromatických uhlovodíků:
Míra rozpustnosti se odráží v intenzitě zabarvení vzniklých roztoků. Méně rozpustný než v arenech je v cyklohexanu a tetrachlormethanu. Roztoky chloridu tantaličného mají nízkou vodivost, což je důkazem nízké míry disociace.
Chlorid tantaličný je možné čistit sublimací.
Příprava
Chlorid tantaličný lze připravit reakcí práškového tantalu s plynným chlorem při teplotách mezi 170 a 250 °C nebo s chlorovodíkem při teplotě 400 °C:[4]
- 2 Ta + 5 Cl2 → 2 TaCl5
- 2 Ta + 10 HCl → 2 TaCl5 + 5 H2
Další možností je reakce oxidu tantaličného s chloridem thionylu při teplotě 240 °C:[2][5]
- Ta2O5 + 5 SOCl2 → 2 TaCl5 + 5 SO2
Chlorid tantaličný je dostupný i komerčně, ale často je kontaminován TaOCl3, který vzniká hydrolýzou.
Reakce
Chlorid tantaličný je elektrofilní a dokáže katalyzovat Friedelovy-Craftsovy alkylace a acylace. S Lewisovými bazemi vytváří adukty.
Tvorba aduktů
Vytváří stabilní komplexy s ethery:
- TaCl5 + R2O → TaCl5(OR2) (R = Me, Et)
Reakcí s chloridem fosforečným a chloridem fosforylu vzniká iontový komplex, chlorid fosforečný vystupuje jako donor chloridu, zatímco se chlorid fosforylu koordinuje k tantalu kyslíkovým atomem:
- TaCl5 + PCl5 → [PCl +
4 ][TaCl -
6 ]- TaCl5 + POCl3 → [TaCl5(OPCl3)]
S terciárními aminy poskytuje krystalické adukty:
- TaCl5 + 2 R3N → [TaCl5(NR3)]
Záměna chloridů
Reakce s nadbytkem trifenylfosfinoxidu poskytuje za laboratorní teploty oxid-chlorid:
- TaCl5 + 3 OPPh3 → [TaOCl3(OPPh3)]x ...
Reakcí se sloučeninami s OH skupinou vznikají chloridy-alkoxidy tantaličné:
- TaCl5 + 3 HOEt → TaCl2(OEt)3 + 3 HCl
V přítomnosti amoniaku, který vystupuje jako akceptor chlorovodíku vzniká až Ta(OEt)5.
Podobně reaguje s roztokem methoxidu lithného v bezvodém methanolu:
- TaCl5 + 4 LiOMe → Ta(OMe)4Cl + 4 LiCl
Redukce

Redukcí chloridu tantaličného pomocí Ga[GaCl4] získáme iontové nebo neutrální klastry [Ta6Cl18]4− a [Ta6Cl14](H2O)4.[6]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Tantalum(V) chloride na anglické Wikipedii.
- ↑ a b GREENWOOD, Norman Neill. Chemie prvků. Sv. 1.. 1. vyd. vyd. Praha: Informatorium 793 s., 1 příl s. ISBN 80-85427-38-9, ISBN 978-80-85427-38-7. S. 1221–1226.
- ↑ a b c d e HOUSECROFT, Catherine; SHARPE, Alan. Anorganická chemie. 1. vyd. Praha: VŠCHT, 2014. 1119 s. ISBN 978-0273-74275-3. S. 773.
- ↑ RABE, Susanne; MÜLLER, Ulrich. Crystal structure of tantalum pentachloride, (TaCl5)2. Zeitschrift für Kristallographie - New Crystal Structures. 2000-01-01, roč. 215, čís. 1, s. 1–2. Dostupné online [cit. 2023-05-16]. ISSN 2197-4578. DOI 10.1515/ncrs-2000-0102.
- ↑ YOUNG, Ralph C.; BRUBAKER, Carl H. Reaction of Tantalum with Hydrogen Chloride, Hydrogen Bromide and Tantalum Pentachloride; Action of Hydrogen on Tantalum Pentachloride. Journal of the American Chemical Society. 1952-10, roč. 74, čís. 19, s. 4967–4967. Dostupné online [cit. 2023-05-17]. ISSN 0002-7863. DOI 10.1021/ja01139a524. (anglicky)
- ↑ THERON, Thomas Arnoldus. Quantification of tantalum in series of tantalum-containing compounds [online]. [cit. 2023-05-17]. S. 27. Dostupné v archivu pořízeném dne 2023-05-17.
- ↑ DURAISAMY, Thirumalai; HAY, Daniel N. T.; MESSERLE, Louis. Octahedral Hexatantalum Halide Clusters. Příprava vydání Gregory S. Girolami, Alfred P. Sattelberger. Hoboken, NJ, USA: John Wiley & Sons, Inc. Dostupné online. ISBN 978-1-118-74499-4, ISBN 978-1-118-74487-1. DOI 10.1002/9781118744994.ch1. S. 1–8. DOI: 10.1002/9781118744994.ch1.
Externí odkazy
 Obrázky, zvuky či videa k tématu Chlorid tantaličný na Wikimedia Commons
Obrázky, zvuky či videa k tématu Chlorid tantaličný na Wikimedia Commons
Média použitá na této stránce
(c) Materialscientist at en.wikipedia, CC BY-SA 3.0
TaCl5. Green atoms are chlorine
Journal = ZKNSFT, Year = 2000, Volume = 215, Page = 1–2, Authors = Rabe S., Müller U.
Autor: Smokefoot, Licence: CC BY-SA 4.0
Ta6Cl18]2- from The Crystal Structure of H2 (Ta6 Cl18) (H2 O)6 Thaxton, C.B.; Jacobson, R.A. Inorganic Chemistry (1971) 10, (*) p1460-p1463