Chlorid thoričitý
| chlorid thoričitý | |
|---|---|
 | |
 | |
| Obecné | |
| Systematický název | Chlorid thoričitý |
| Anglický název | Thorium(IV) chloride |
| Německý název | Thorium(IV)-chlorid |
| Sumární vzorec | ThCl4 |
| Vzhled | bílá pevná látka |
| Identifikace | |
| Registrační číslo CAS | 10026-08-1 54327-76-3 |
| EC-no (EINECS/ELINCS/NLP) | 233-056-1 |
| PubChem | 66209 |
| SMILES | Cl[Th](Cl)(Cl)Cl |
| InChI | InChI=1S/4ClH.Th/h4*1H;/q;;;;+4/p-4 Key: WEQHQGJDZLDFID-UHFFFAOYSA-J |
| Číslo RTECS | XO6475000 |
| Vlastnosti | |
| Molární hmotnost | 373,849 g/mol |
| Teplota tání | 770 °C (1420 °F; 1040 K) |
| Teplota varu | 921 °C (1690 °F; 1194 K) |
| Teplota změny krystalové modifikace | 405 °C (761 °F; 678 K) |
| Hustota | 4,59 g/cm3 |
| Rozpustnost ve vodě | snadno rozpustný |
| Struktura | |
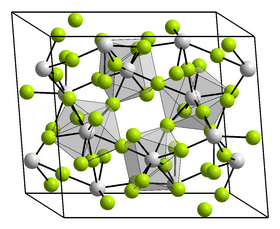
| Krystalová struktura | tetragonální |
| Hrana krystalové mřížky | a = 847,3 pm, c = 746,8 pm |
Některá data mohou pocházet z datové položky. | |
Chlorid thoričitý je anorganická sloučenina s chemickým vzorcem ThCl4. Vyskytuje se také ve formě tetrahydrátu a oktahydrátu.
Příprava
Chlorid thoričitý byl meziproduktem v izolaci kovového thoria, kterou provedl Jöns Jacob Berzelius.[1]
Chlorid thoričitý lze připravit mnoha způsoby. Jednou z metod je karbotermická redukce při teplotě 700 °C až 2600 °C, kdy oxid thoričitý reaguje s uhlíkem v proudu plynného chloru:
- ThO2 + 2 C + 4 Cl2 → ThCl4 + 2 CO
Chloraci lze provést za pomocí chloridu uhličitého:[2][3]
- Th(C2O4)2 + CCl4 → ThCl4 + 3 CO + 3 CO2
- ThO2 + 2 CCl4 → ThCl4 + 2 COCl2
Další metoda je dvoukroková, kdy v prvním kroku reaguje thorium s chloridem amonným:
- Th + 6 NH4Cl → (NH4)2ThCl6 + 4 NH3 + 2 H2
V druhém kroku se výsledná sůl zahřeje na teplotu 350 °C ve vysokém vakuu za vzniku chloridu thoričitého.[4]
Bezvodý chlorid thoričitý lze z hydrátu připravit za pomocí chloridu thionylu a zahřátí nad 100 °C:[5]
- ThCl4·8H2O + 8 SOCl2 → ThCl4 + 8 SO2 + 16 HCl
Lze jej také připravit například syntézou z prvků nebo reakcí hydridu thoričitého s chlorovodíkem.[5]
Vlastnosti
Chlorid thoričitý je bílá, hygroskopická krystalická pevná látka, kterou lze získat sublimací ve formě velkých jehel. Je snadno rozpustný ve vodě. Krystalizuje v tetragonální soustavě s prostorovou grupou I41/amd (číslo 141) s parametry mřížky a = 847,3 pm a c = 746,8 pm a je izotypický s chloridem uraničitým.[6] Při teplotě nad 405 °C se vyskytuje v další modifikaci, která krystalizuje rovněž v tetragonální soustavě a je metastabilní při ochlazení pod teplotu 405 °C.[5]
Reaktivita
Chlorid thoričitý reaguje s řadou organický sloučenin obsahujících kyslík.[7]
Adukty s Lewisovými zásadami
Chlorid thoričitý reaguje s Lewisovými zásadami za vzniku molekulárních aduktů, jako ThCl4(DME)2 a ThCl4(TMEDA)2.[4]
Redukce na kovové thorium
Chlorid thoričitý je meziproduktem při čištění thoria, který může být ovlivněn:
- Redukcí chloridu thoričitého alkalickými kovy.
- Elektrolýzou bezvodého chloridu thoričitého v tavenině chloridu sodného a chloridu draselného.
- Redukcí směsi chloridu thoričitého a bezvodého chloridu zinečnatého vápníkem.[8]
Využití
Chlorid thoričitý se používá jako meziprodukt při výrobě thoria, kterou provedl již Berzelius při objevu thoria redukcí draslíkem.[9][10]
Reference
V tomto článku byly použity překlady textů z článků Thorium(IV) chloride na anglické Wikipedii a Thorium(IV)-chlorid na německé Wikipedii.
- ↑ WEEKS, Mary Elvira. The discovery of the elements. XI. Some elements isolated with the aid of potassium and sodium: Zirconium, titanium, cerium, and thorium. Journal of Chemical Education. 1932-07, roč. 9, čís. 7, s. 1231. Dostupné online [cit. 2024-07-28]. ISSN 0021-9584. doi:10.1021/ed009p1231. (anglicky)
- ↑ BRAUER, Georg. Handbook of Preparative Inorganic Chemistry. [s.l.]: Academic Press 1038 s. Dostupné online. ISBN 978-0-12-126601-1. (anglicky)
- ↑ GUTIERREZ, R.L.; HERBST, R.J.; JOHNSON, K.W.R. Preliminary fabrication studies of alternative LMFBR carbide fuels. [s.l.]: [s.n.] Dostupné online. doi:10.2172/5688597. (anglicky)
- ↑ a b CANTAT, Thibault; SCOTT, Brian L.; KIPLINGER, Jaqueline L. Convenient access to the anhydrous thorium tetrachloride complexes ThCl4(DME)2, ThCl4(1,4-dioxane)2 and ThCl4(THF)3.5 using commercially available and inexpensive starting materials. Chemical Communications. 2010, roč. 46, čís. 6, s. 919. Dostupné online [cit. 2024-07-28]. ISSN 1359-7345. doi:10.1039/b923558b. PMID 20107650. (anglicky)
- ↑ a b c MORSS, L. R.; EDELSTEIN, Norman M.; FUGER, Jean. The Chemistry of the Actinide and Transactinide Elements (Set Vol.1-6): Volumes 1-6. [s.l.]: Springer Science & Business Media 4511 s. Dostupné online. ISBN 978-94-007-0211-0. S. 80. (anglicky)
- ↑ BRAUER, Georg. Handbuch der präparativen anorganischen Chemie. [s.l.]: F. Enke 626 s. Dostupné online. ISBN 978-3-432-02328-1. S. 1136. (německy)
- ↑ JANTSCH, G.; URBACH, W. Über Verbindungen des Thoriums. I. Über Additions‐ und Substitutionsverbindungen des Thoriumchlorids. Helvetica Chimica Acta. 1919-01, roč. 2, čís. 1, s. 490–500. Dostupné online [cit. 2024-07-28]. ISSN 0018-019X. doi:10.1002/hlca.19190020152. (anglicky)
- ↑ HOBART, David. Periodic Table of Elements: Los Alamos National Laboratory. periodic.lanl.gov [online]. [cit. 2024-07-28]. Dostupné online.
- ↑ MURTHY, C. Parameshwara. University Chemistry, Vol. Ii. [s.l.]: New Age International 658 s. Dostupné online. ISBN 978-81-224-0955-0. S. 69. (anglicky)
- ↑ Nuclear and Radiation Chemistry. [s.l.]: Krishna Prakashan Media 356 s. Dostupné online. ISBN 978-81-85842-63-9. S. 158. (anglicky)
Média použitá na této stránce
Autor: Orci, Licence: CC BY-SA 3.0
Crystal structure of Uranium tetrafluoride

