Chlorid vanadičitý
| Chlorid vanadičitý | |
|---|---|
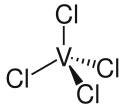
 Strukturní vzorec VCl4 | |
| Obecné | |
| Systematický název | Chlorid vanadičitý |
| Anglický název | Vanadium tetrachloride |
| Německý název | Vanadium(IV)-chlorid |
| Sumární vzorec | VCl4 |
| Vzhled | červená kapalina, citlivá na vlhkost |
| Identifikace | |
| Registrační číslo CAS | 7632-51-1 |
| PubChem | 24273 |
| SMILES | Cl[V](Cl)(Cl)Cl |
| InChI | 1S/4ClH.2V/h4*1H;;/q;;;;2*+2/p-4 |
| Vlastnosti | |
| Molární hmotnost | 192,75 g/mol |
| Teplota tání | −24,5 °C |
| Teplota varu | 148 °C |
| Hustota | 1,816 g/cm3 |
| Rozpustnost ve vodě | rozkládá se |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Chlorid vanadičitý, VCl4, je červená olejovitá a jedovatá kapalina,[1] která se využívá jako výchozí látka pro přípravu dalších sloučenin vanadu. V kapalném i plynném stavu se skládá z tetraedrických molekul.[2]
Syntéza a vlastnosti
Chlorid vanadičitý se připravuje chlorací kovového vanadu. To je umožněno tím, že plynný chlor není dost silným oxidačním činidlem, aby vznikal chlorid vanadičný.[1]
Protože má vanad o jeden valenční elektron více než titan, je chlorid vanadičitý, na rozdíl od titaničitého, paramagnetický. Je to jedna z mála paramagnetických sloučenin, která je za laboratorní teploty kapalná.
Reakce
Díky silným oxidačním vlastnostem dokáže reakcí s HBr při teplotě −50 °C uvolnit elementární brom. Meziproduktem je VBr4, který při ohřevu na laboratorní teplotu uvolňuje brom:[3]
- 2 VCl4 + 8 HBr → 2 VBr3 + 8 HCl + Br2
Vytváří adukty s donorovými ligandy, např. THF:[4]
- VCl4 + 2 THF → VCl4(THF)2
Je prekurzorem pro přípravu vanadocen dichloridu.
Využití
Chlorid vanadičitý se využívá jako katalyzátor polymerací alkenů, zejména pro využití v gumárenském průmyslu
Bezpečnost
VCl4 je těkavá, agresivní kapalina s oxidačními účinky. Při styku s vlhkostí uvolňuje HCl.
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Vanadium tetrachloride na anglické Wikipedii.
- ↑ a b GREENWOOD, Norman Neill. Chemie prvků. Sv. 1.. 1. vyd. vyd. Praha: Informatorium 793 s., 1 příl s. Dostupné online. ISBN 80-85427-38-9, ISBN 978-80-85427-38-7. OCLC 320245801 S. 1222.
- ↑ HOUSECROFT, Catherine E. Anorganická chemie. Vyd. 1. vyd. Praha: Vysoká škola chemicko-technologická v Praze xxx, 1119 s. s. Dostupné online. ISBN 978-80-7080-872-6, ISBN 80-7080-872-1. OCLC 894846634 S. 712–714.
- ↑ CALDERAZZO, Fausto; MAICHLE-MÖSSMER, Cäcilie; PAMPALONI, Guido. Low-temperature syntheses of vanadium( III ) and molybdenum( IV ) bromides by halide exchange. J. Chem. Soc., Dalton Trans.. 1993, čís. 5, s. 655–658. Dostupné online [cit. 2022-01-22]. ISSN 0300-9246. DOI 10.1039/DT9930000655. (anglicky)
- ↑ BRIDGLAND, B.E.; FOWLES, G.W.A.; WALTON, R.A. Some complexes of vanadium(IV) chloride. Journal of Inorganic and Nuclear Chemistry. 1965-02, roč. 27, čís. 2, s. 383–389. Dostupné online [cit. 2022-01-22]. DOI 10.1016/0022-1902(65)80356-6. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu Chlorid vanadičitý na Wikimedia Commons
Obrázky, zvuky či videa k tématu Chlorid vanadičitý na Wikimedia Commons
Média použitá na této stránce
Structure of vanadium tetrachloride