Chlorid vanaditý
| Chlorid vanaditý | |
|---|---|
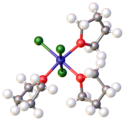
 Krystalová struktura VCl3 | |
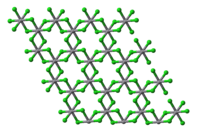
 Vrstvy v krystalu VCl3 | |
| Obecné | |
| Systematický název | Chlorid vanaditý |
| Anglický název | Vanadium(III) chloride |
| Německý název | Vanadium(III)-chlorid |
| Sumární vzorec | VCl3 |
| Vzhled | fialové krystaly |
| Identifikace | |
| Registrační číslo CAS | 7718-98-1 |
| PubChem | 62647 |
| SMILES | [V+3].[Cl-].[Cl-].[Cl-] |
| InChI | 1S/3ClH.V/h3*1H;/q;;;+3/p-3 |
| Vlastnosti | |
| Molární hmotnost | 157,30 g/mol |
| Teplota tání | >300 °C (rozklad) |
| Hustota | 3,0 g/cm3 |
| Rozpustnost ve vodě | rozpustný |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Chlorid vanaditý, VCl3, je fialová pevná látka.[1] Slouží jako prekurzor pro přípravu jiných sloučenin vanadu.
Struktura
VCl3 má strukturu jodidu bismutitého, chloridové anionty jsou uspořádány do nejtěsnějšího hexagonálního uspořádání a vanadité ionty obsazují oktaedrické mezery. Stejnou strukturu mají i bromid a jodid vanaditý, ale VF3 se strukturou blíží spíše oxidu rheniovému. VCl3 je paramagnetický, má dva nepárové elektrony.
Příprava a reakce
Chlorid vanaditý se připravuje zahříváním VCl4 na teplotu 160-170 °C v proudu inertního plynu, který odnáší vznikající chlor.[2][3]
- 2 VCl4 → 2 VCl3 + Cl2
Zahříváním dochází k disproporcionaci:[2][3]
- 2 VCl3 → VCl4 + VCl2
Zahříváním ve vodíkové atmosféře na teplotu 675 °C dochází k redukci:[4]
- 2 VCl3 + H2 → 2 VCl2 + 2 HCl
Refluxem v THF a následnou krystalizací lze získat oktaedrický solvát VCl3(THF)3.[5]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Vanadium(III)_chloride na anglické Wikipedii.
- ↑ GREENWOOD, Norman Neill. Chemie prvků. Sv. 1.. 1. vyd. vyd. Praha: Informatorium 793 s., 1 příl s. Dostupné online. ISBN 80-85427-38-9, ISBN 978-80-85427-38-7. OCLC 320245801 S. 1224.
- ↑ a b HOUSECROFT, Catherine E. Anorganická chemie. Vyd. 1. vyd. Praha: Vysoká škola chemicko-technologická v Praze xxx, 1119 s. s. Dostupné online. ISBN 978-80-7080-872-6, ISBN 80-7080-872-1. OCLC 894846634 S. 714–715.
- ↑ a b YOUNG, Ralph C.; SMITH, Maynard E.; MOELLER, Therald. Vanadium(III) Chloride. Příprava vydání John C. Bailar. Hoboken, NJ, USA: John Wiley & Sons, Inc. Dostupné online. ISBN 978-0-470-13235-7, ISBN 978-0-470-13163-3. DOI 10.1002/9780470132357.ch43. S. 128–130. DOI: 10.1002/9780470132357.ch43.
- ↑ YOUNG, Ralph C.; SMITH, Maynard E.; MOELLER, Therald. Vanadium(II) Chloride. Příprava vydání John C. Bailar. Hoboken, NJ, USA: John Wiley & Sons, Inc. Dostupné online. ISBN 978-0-470-13235-7, ISBN 978-0-470-13163-3. DOI 10.1002/9780470132357.ch42. S. 126–127. DOI: 10.1002/9780470132357.ch42.
- ↑ MANXZER, L. E.; DEATON, Joe; SHARP, Paul. 31. Tetragtdrfuran Complexes of Selected Early Transition Metals.. Příprava vydání John P. Fackler. Hoboken, NJ, USA: John Wiley & Sons, Inc. Dostupné online. ISBN 978-0-470-13252-4, ISBN 978-0-471-86520-9. DOI 10.1002/9780470132524.ch31. S. 135–140. DOI: 10.1002/9780470132524.ch31.
Externí odkazy
 Obrázky, zvuky či videa k tématu Chlorid vanaditý na Wikimedia Commons
Obrázky, zvuky či videa k tématu Chlorid vanaditý na Wikimedia Commons
Média použitá na této stránce
Ball-and-stick model of a single layer (plan view) in the crystal structure of vanadium(III) chloride, VCl3.
Based on the crystal structure reported in W. Klemm, E. Krose, Z. Anorg. Allg. Chem. 1947, 253, 218-225. Crystallographic data from the Crystallography Open Database.
Colour code:
- Vanadium, V: grey
- Chlorine, Cl: green
Ball-and-stick model of layer stacking in the crystal structure of vanadium(III) chloride, VCl3.
Based on the crystal structure reported in W. Klemm, E. Krose, Z. Anorg. Allg. Chem. 1947, 253, 218-225. Crystallographic data from the Crystallography Open Database.
Colour code:
- Vanadium, V: grey
- Chlorine, Cl: green