Chlorid zinečnatý
| Chlorid zinečnatý | |
|---|---|
 | |
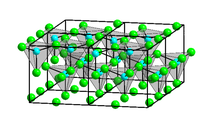 Krystalová struktura chloridu zinečnatého | |
| Obecné | |
| Systematický název | chlorid zinečnatý |
| Latinský název | Zinci chloridum |
| Anglický název | Zinc chloride |
| Německý název | Zinkchlorid |
| Sumární vzorec | ZnCl2 |
| Vzhled | bílý prášek nebo krystalky |
| Identifikace | |
| Registrační číslo CAS | 7646-85-7 |
| EC-no (EINECS/ELINCS/NLP) | 231-592-0 |
| Indexové číslo | 030-003-00-2 |
| PubChem | 3007855 |
| UN kód | 2331 |
| Číslo RTECS | ZH1400000 |
| Vlastnosti | |
| Molární hmotnost | 136,315 g/mol |
| Teplota tání | 293 °C |
| Teplota varu | 732 °C |
| Hustota | 2,907 g/cm3 (20 °C) 2,905 g/cm3 (25 °C) |
| Index lomu | nDř= 1,687 nDm= 1,713 |
| Rozpustnost ve vodě | 342 g/100 g (0 °C) 396 g/100 g (20 °C) 408 g/100 g (25 °C) 437,15 g/100 g (30 °C) 453 g/100 g (40 °C) 468,02 g/100 g (50 °C) 488,78 g/100 g (60 °C) 542 g/100 g (80 °C) 613,54 g/100 g (100 °C) |
| Rozpustnost v polárních rozpouštědlech | methanol ethanol 100 g/100 g (12,5 °C) aceton 43,5 g/100 g (18 °C) roztok čpavku kapalný amoniak (ne) |
| Rozpustnost v nepolárních rozpouštědlech | pyridin 2,6 g/100 g (20 °C) |
| Měrná magnetická susceptibilita | −5,6310−6 cm3g−1 |
| Povrchové napětí | 53,8 mN/m (320 °C) 53,6 mN/m (400 °C) 52,2 mN/m (700 °C) |
| Struktura | |
| Krystalová struktura | klencová |
| Hrana krystalové mřížky | a= 527 pm α= 91°30´ |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −415,1 kJ/mol |
| Entalpie tání ΔHt | 75,2 J/g |
| Entalpie varu ΔHv | 875 J/g |
| Entalpie rozpouštění ΔHrozp | −514 J/g |
| Standardní molární entropie S° | 111,5 JK−1mol−1 |
| Standardní slučovací Gibbsova energie ΔGf° | −369,5 kJ/mol |
| Izobarické měrné teplo cp | 0,523 JK−1g−1 |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H302 H314 H410 |
| R-věty | R22 R34 R50/53 |
| S-věty | (S1/2) S26 S36/37/39 S45 S60 S61 |
| NFPA 704 | |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Chlorid zinečnatý je anorganická sloučenina chloru a zinku (chemický vzorec ZnCl2). Existuje v devíti známých krystalových formách. Jedná se o bezbarvou nebo bílou látku dobře rozpustnou ve vodě. ZnCl2 je hygroskopický a navlhavý, proto musí být chráněn před vlhkostí, včetně vodních par ve vzduchu. Používá se v široké škále aplikací při zpracování textilu, jako tavidlo a v chemické syntéze.
Není znám žádný minerál s tímto chemickým složením, existuje však velmi vzácný nerost simonkolleit se vzorcem Zn5(OH)8Cl2·H2O.
Bezpečnost
Chlorid zinečnatý dráždí kůži a dýchací ústrojí.[2] Bezpečnostní opatření, která se vztahují k bezvodému ZnCl2, platí i pro jiné bezvodé halogenidy kovů, tj. jejich hydrolýza může být exotermická a je třeba se vyhýbat kontaktu s těmito látkami. Koncentrované roztoky jsou kyselé a žíravé, jakožto Lewisova kyselina poškozují celulózu a hedvábí.
Reference
V tomto článku byl použit překlad textu z článku Zinc chloride na anglické Wikipedii.
- ↑ a b Zinc chloride. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ Archivovaná kopie. www.jtbaker.com [online]. [cit. 2009-09-23]. Dostupné v archivu pořízeném dne 2009-01-05.
Literatura
- N. N. Greenwood, A. Earnshaw, Chemistry of the Elements, 2nd ed., Butterworth-Heinemann, Oxford, UK, 1997.
- Handbook of Chemistry and Physics, 71st edition, CRC Press, Ann Arbor, Michigan, 1990.
- The Merck Index, 7th edition, Merck & Co, Rahway, New Jersey, USA, 1960.
- D. Nicholls, Complexes and First-Row Transition Elements, Macmillan Press, London, 1973.
- J. March, Advanced Organic Chemistry, 4th ed., p. 723, Wiley, New York, 1992.
- G. J. McGarvey, in Handbook of Reagents for Organic Synthesis, Volume 1: Reagents, Auxiliaries and Catalysts for C-C Bond Formation, (R. M. Coates, S. E. Denmark, eds.), pp. 220–3, Wiley, New York, 1999.
- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Externí odkazy
 Obrázky, zvuky či videa k tématu chlorid zinečnatý na Wikimedia Commons
Obrázky, zvuky či videa k tématu chlorid zinečnatý na Wikimedia Commons - Grades and Applications of Zinc Chloride
- PubChem ZnCl2 summary.
- External MSDS Data Sheet Archivováno 1. 7. 2007 na Wayback Machine.
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
Zinc chloride hydrate
Autor: Orci, Licence: CC BY-SA 3.0
Crystal structure of α-Zinc chloride









