Chlorid zlatitý
| Chlorid zlatitý | |
|---|---|
 Roztok | |
 Strukturní vzorec | |
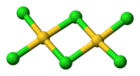 3D vzorec | |
| Obecné | |
| Systematický název | Chlorid zlatitý |
| Anglický název | Gold(III) chloride |
| Německý název | Gold(III)-chlorid |
| Sumární vzorec | AuCl3, Au2Cl6 (dimer) |
| Vzhled | Červená hygroskopická pevná látka |
| Identifikace | |
| Registrační číslo CAS | 13453-07-1 |
| Číslo RTECS | MD5420000 |
| Vlastnosti | |
| Molární hmotnost | 303,326 g/mol |
| Teplota tání | 288 °C (od 185 °C pozvolný rozklad) |
| Teplota sublimace | 265 °C |
| Hustota | 4,67 g/cm3 |
| Rozpustnost ve vodě | 68 g/100 g |
| Měrná magnetická susceptibilita | 4,65×10−6cm3g−1 |
| Struktura | |
| Krystalová struktura | jednoklonná |
| Koordinační geometrie | čtvercově rovinná |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −118,4 kJ/mol |
| Standardní molární entropie S° | 164,4 JK−1mol−1 |
| Standardní slučovací Gibbsova energie ΔGf° | −53,6 kJ/mol |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R34, R36/37/38 |
| S-věty | S26, S36, S36/37/39 |
Některá data mohou pocházet z datové položky. | |
Chlorid zlatitý (chemický vzorec AuCl3) je nejběžnější sloučeninou zlata. Z českého chemického názvosloví vyplývá, že je zlato v této sloučenině v oxidačním čísle III+. Existují ještě dvě sloučeniny zlata s chlorem, chlorid zlatný a kyselina chlorozlatitá.
Příprava
Chlorid zlatitý se nejčastěji připravuje přímou chlorací čistého zlata za vysokých teplot:
- 2 Au + 3 Cl2 → 2 AuCl3
Vlastnosti
Bezvodý chlorid zlatitý se již za teploty okolo 160 °C rozkládá v chlorid zlatný. Touto reakcí se dá připravovat čisté zlato, protože chlorid zlatný se následně za teploty okolo 420 °C rozkládá na zlato a zpět na chlorid zlatitý (dochází k disproporcionaci):
- AuCl3 → AuCl + Cl2
- 3 AuCl → AuCl3 + 2 Au
Reakcí s vodným roztokem kyseliny chlorovodíkové vzniká komplexní sloučenina nazývaná kyselina chlorozlatitá:[2]
- HCl (aq) + AuCl3 (aq) → HAuCl4 (aq)
Obdobně probíhá reakce chloridu zlatitého s chloridy, produktem jsou poté příslušné chlorozlatitany.
Struktura molekuly
Chlorid zlatitý existuje, podobně jako bromid zlatitý, jako dimer. To znamená, že jeho molekula vypadá takto:
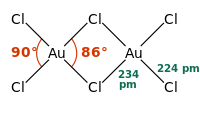
Použití
Chlorid zlatitý je nejběžnější chemickou sloučeninou zlata, pro přípravu ostatních sloučenin zlata bývá výchozí látkou. Připravuje se z něj např. komplexní sloučenina tetrakyanozlatitan draselný:
Chlorozlatité soli, hlavně tetrachlorozlatitan sodný, vznikající reakcí chloridu zlatitého a chloridu sodného, se používají jako katalyzátor při reakcích.
Ve fotografii se používá jako tónovací lázeň.
Odkazy
Reference
Související články
- chlorid zlatný
- kyselina chlorozlatitá
- bromid zlatitý
Externí odkazy
 Obrázky, zvuky či videa k tématu chlorid zlatitý na Wikimedia Commons
Obrázky, zvuky či videa k tématu chlorid zlatitý na Wikimedia Commons
Literatura
- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Média použitá na této stránce
Autor: Tento vektorový obrázek byl vytvořen programem Adobe Illustrator., Licence: CC0
The structure of w:gold(III) chloride in the solid state.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Koncentrovaný roztok chloridu zlatitého, AuCl3






