Chroman draselný
| Chroman draselný | |
|---|---|
 Vzhled | |
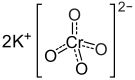 Struktura | |
| Obecné | |
| Systematický název | Chroman draselný |
| Sumární vzorec | K2CrO4 |
| Vzhled | žlutá krystalická látka |
| Identifikace | |
| Registrační číslo CAS | 7789-00-6 |
| Vlastnosti | |
| Molární hmotnost | 194,19 g/mol |
| Teplota tání | 968 °C, 1 241 K |
| Teplota varu | 1 000 °C, 1 273 K |
| Hustota | 2,732 0 g/cm3 |
| Index lomu | 1,74 |
| Rozpustnost ve vodě | 62,9 g/100 g H2O (při 20 °C) 79,2 g/100 g H2O (při 100 °C) |
| Rozpustnost v polárních rozpouštědlech | nerozpustný v ethanolu |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H340 H350i H319 H335 H317 H315 H410 |
| P-věty | P201 P273 P280 P305 P308 P302 |
Některá data mohou pocházet z datové položky. | |
Chroman draselný je žlutá krystalická látka se vzorcem K2CrO4.
Výroba
Tato látka se běžně vyrábí reakcí oxidu chromitého s hydroxidem draselným za přítomnosti oxidačního činidla, v tomto případě dusičnanu draselného:
2Cr2O3 + 8KOH + 6KNO3 —t→ 4K2CrO4 + 4H2O + 6KNO2
V minulosti se tato látka vyráběla průmyslově zahříváním chromitu (FeCr2O4) s potašem (K2CO3) na vysokou teplotu, vzniklé množství chromanu draselného bylo rozpuštěno ve vodě a odfiltrováno od nerozpustných nečistot. Vzniklý produkt byl silně znečištěn, pro původní účely to ale bylo dostačující.
Reakce
V kyselém prostředí (nejčastěji s kyselinou dusičnou, s mnoha dalšími reaguje jinak!) se dvě molekuly chromanu draselného spojují za vzniku dichromanové molekuly, dle rovnice:
2K2CrO4 —HNO3→ 2K+ + K2Cr2O7
Průběh reakce je doprovázen změnou barvy roztoku ze žluté do oranžova.
V extrémně kyselém prostředí (opět s kyselinou dusičnou) se spojují tři molekuly za vzniku trichromanu, dle rovnice:
3K2CrO4 —HNO3→ 4K+ + K2Cr3O10
Roztok mění barvu z jasně žluté barvy přes oranžovou až po krvavě červenou barvu, způsobenou trichromanem draselným.
S kyselinou sírovou reaguje za vzniku kyseliny chromové, ta se pak dále rozpadá na oxid chromový.
K2CrO4 + H2SO4 → H2CrO4 + K2SO4 → H2O + CrO3 + K2SO4
S kyselinou chlorovodíkovou reaguje za vzniku chloridu draselného, chromitého a chloru:
2K2CrO4 + 12HCl → 4KCl + 2CrCl3 + 6H2O + Cl2
Dále tato látka reaguje s dusičnanem olovnatým za vzniku chromanu olovnatého, též zvaný chromová žluť:
K2CrO4 + Pb(NO3)2 → PbCrO4 + 2KNO3
Využití
Dříve se tato látka ve velké míře používala již zmíněnou reakcí na výrobu chromové žluti. Její používání se však v Evropě pro toxicitu a karcinogenitu již omezuje, stále je však ve velké míře užíváno ve Spojených státech.
Tato látka se dále využívá v chemickém průmyslu, zejména pak na syntézu dichromanu s celou řadou užití.
Bezpečnost
Tato látka je velice jedovatá při požití. Tato látka je taky karcinogenní, při vdechování je spojován s rakovinou plic. Při smíchání s hořlavými látkami dochází často ke vznícení, jedná se totiž o silné oxidační činidlo.
Reference
V tomto článku byl použit překlad textu z článku Potassium chromate na anglické Wikipedii.
- ↑ a b Potassium chromate. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu chroman draselný na Wikimedia Commons
Obrázky, zvuky či videa k tématu chroman draselný na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
Potassium chromate, structural formula
Chroman draselný, K2CrO4







