Chromylchlorid
| Chromylchlorid | |
|---|---|
 Lahvička s chromylchloridem | |
 Strukturní vzorec | |
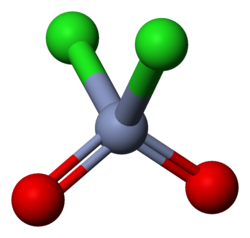
 3D model | |
| Obecné | |
| Systematický název | dichlorid-dioxid chromový |
| Anglický název | Chromyl chloride |
| Sumární vzorec | CrO2Cl2 |
| Vzhled | krvavě červená dýmavá kapalina podobná bromu |
| Identifikace | |
| Registrační číslo CAS | 14977-61-8 |
| EC-no (EINECS/ELINCS/NLP) | 239-056-8 |
| PubChem | 22150757 |
| ChEBI | CHEBI:33038 |
| UN kód | 1758 |
| SMILES | Cl[Cr](Cl)(=O)=O |
| InChI | InChI=1S/2ClH.Cr.2O/h2*1H;;;/q;;+2;;/p-2 |
| Číslo RTECS | GB5775000 |
| Vlastnosti | |
| Molární hmotnost | 154,9008 g/mol |
| Teplota tání | −96,5 °C (176,7 K) |
| Teplota varu | 117 °C (390 K) |
| Bezpečnost | |
| H-věty | H271 H314 H317 H340 H350 H410 |
| P-věty | P201 P210 P280 P303+361+353 P305+351+338+310 P308+313[1] |
| NFPA 704 | |
Některá data mohou pocházet z datové položky. | |
Chromylchlorid je anorganická sloučenina se vzorcem CrO2Cl2. Jedná se o červenohnědou sloučeninu, která je při pokojové teplotě těkavá, což je pro sloučeniny přechodných kovů neobvyklé.
Příprava
Chromylchlorid lze připravit reakcí chromanu draselného nebo dichromanu draselného s chlorovodíkem v přítomnosti kyseliny sírové a následnou destilací.[2][3]
- K2Cr2O7 + 6 HCl → 2 CrO2Cl2 + 2 KCl + 3 H2O
Kyselina sírová slouží jako dehydratační činidlo. Lze jej také připravit reakcí oxidu chromového s bezvodým chlorovodíkem:
- CrO3 + 2 HCl ⇌ CrO2Cl2 + H2O
Metoda používaná k přípravě chromylchloridu je základem kvalitativního testu na chloridy: vzorek podezřelý z obsahu chloridů se zahřeje se směsí dichromanu draselného a koncentrované kyseliny sírové. Je-li přítomen chlorid, vzniká chromylchlorid, což se projeví červenými výpary CrO2Cl2. Analogické sloučeniny se netvoří s fluoridy, bromidy, jodidy a kyanidy.
Činidlo pro oxidaci alkenů
Chromylchlorid oxiduje vnitřní alkeny na alfa-chlorketony nebo příbuzné deriváty.[4] Rovněž působí na benzylové methylové skupiny za vzniku aldehydů Étardovou reakcí. Vhodným rozpouštědlem pro tyto reakce je dichlormethan.[5]
Bezpečnostní aspekty

Chromylchlorid se při styku s vodou prudce rozkládá za vzniku kyseliny chlorovodíkové (HCl) a kyseliny chromové (H2CrO4). Přestože není hořlavý, je silným oxidačním činidlem a při styku s hořlavými látkami se může samovolně vznítit nebo explodovat. V případě požáru nesmí dojít k přímému kontaktu s vodou.
Je navíc silně žíravý a snadno popálí kůži a oči a požití by způsobilo vážné vnitřní zranění. Jeho výpary rovněž silně dráždí všechny části těla.[6]
Časté vystavení kůže chromylchloridu může mít za následek vznik vředů.[6]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Chromyl chloride na anglické Wikipedii.
- ↑ Chromyl chloride 200042 [online]. [cit. 2022-05-16]. Dostupné v archivu pořízeném z originálu dne 2022-05-16.
- ↑ MOODY, B.J. Comparative Inorganic Chemistry. Londýn: Edward Arnold, 1965. 381 s. ISBN 0-7131-3679-0.
- ↑ SISLER, Harry H.; E. RIARCHI, Logis. Chromyl Chloride [Chromium(VI) Dioxychloride]. Příprava vydání W. Conard Fernelius. [s.l.]: [s.n.] ISBN 9780470132333. doi:10.1002/9780470132333.ch63. S. 205–207.
- ↑ FREEMAN, Fillmore; DUBOIS, Richard H.; MCLAUGHLIN, Thomas G. Aldehydes by Oxidation of Terminal Olefins with Chromyl Chloride: 2,4,4-Trimethylpentanal. Org. Synth.. S. 4. doi:10.15227/orgsyn.051.0004.
- ↑ FREEMAN, Fillmore. Chromyl Chloride. [s.l.]: Encyclopedia of Reagents for Organic Synthesis, 2004. ISBN 0471936235. doi:10.1002/047084289X.rc177.
- ↑ a b Laboratory Handbook of Toxic Agents. [s.l.]: Royal Institute of Chemistry, 1966. Dostupné online. S. 79.
Externí odkazy
 Obrázky, zvuky či videa k tématu Chromylchlorid na Wikimedia Commons
Obrázky, zvuky či videa k tématu Chromylchlorid na Wikimedia Commons - Chromyl chloride
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
Autor: 102% Yield, Licence: CC BY-SA 4.0
Chromylchlorid, červená kapalina v zatavených ampulích
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for oxidizing substances
Autor: Д.Ильин: vectorization, Licence: CC0
Strukturní vzorec chromylchloridu, CrO2Cl2
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Ball-and-stick model of the chromyl chloride molecule, CrO2Cl2
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.