Copeův přesmyk
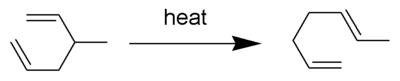
Copeův přesmyk je druh organické reakce, konkrétně [3,3] sigmatropní přesmyk 1,5-dienů,[1][2][3][4] příkladem může být přeměna 3-methyl-hexa-1,5-dienu na hepta-1,5-dien zahřátím na 300 °C.
Mechanismus
Copeův přesmyk je ukázkovým případem sigmatropního přesmyku. Řadí se mezi [3,3]-sigmatropní reakce s Woodwardovým-Hoffmannovým symbolem [π2s+σ2s+π2s] a je tedy termochemicky výhodný. Často bývá vhodné o něm uvažovat jako o reakci, jejíž meziprodukt strukturou odpovídá diradikálu, i když to tak mnohdy nebývá.[5] Níže zobrazený meziprodukt s židličkovou konformací převažuje u systémů s otevřenými řetězci. Systémy, u kterých se výrazně projevují sterické efekty, například cis-1,2-divinylcyklopropany, ovšem mohou reakcí procházet v lodičkové konformaci.
Předpokládá se, že většina Copeových přesmyků probíhá soustředěným mechanismem přes Hückelův aromatický přechodný stav a diradikál se nevytváří. Soustředěné reakce ovšem mohou být asynchronní a reakce elektronově narušených reaktantů mohou probíhat přes diradikálové meziprodukty.[6] Jako příklad lze uvést Copeův přesmyk elektronově neutrálního hexa-1,5-dienu, zobrazený níže. V tomto případě zanikají dvě vazby pí a dvě nové se vytvářejí, podobně také zanikají dvě vazby sigma a dvě nové vznikají. Na rozdíl od Claisenova přesmyku jsou Copeovy přesmyky substrátů nevykazujících narušení sterickými nebo elektronovými efekty často tepelně neutrální a tak může být příslušná přeměna kvůli nízké hodnotě rovnovážné konstanty pouze částečná. U hexa-1,5-dienu je například K = 1.
U asymetrických dienů mohou mít produkty rozdílnou stereochemii, kterou lze u pericyklických reakcí, mezi které patří také Copeův přesmyk, předvídat pomocí Woodwardových–Hoffmannových pravidel; podle těchto pravidel se tvoří převážně produkty se židličkovou konformací.
Příklady
Copeův přesmyk je často využíván v organické syntéze; je symetricky povolený, pokud u všech reaktantů probíhá suprafaciálně; meziprodukt může mít lodičkovou i židličkovou konformaci. Příkladem je rozšíření cyklobutanového cyklu na cyklookta-1,5-dien:
V tomto případě musí reakce probíhat přes meziprodukt s lodičkovou konformací, čímž vzniká nenasycený produkt jako cis-izomer; molekula trans-izomeru by měla příliš velké úhlové napětí. Reakce se provádí za zvýšené teploty. Reakci usnadňuje ztráta úhlového napětí u produktu.
Oxy- a aniontové Copeovy přesmyky
Při oxy-Copeových přesmycích se naváže hydroxylová skupina na C3 za vzniku enolu, který se tautomerizaci přemění na enal nebo enon.[7][8]
Původní reakce musela být, aby probíhala přijatelnou rychlostí, prováděna za vysokých teplot. V roce 1975 však David A. Evans a A. M. Golob ukázali, že deprotonace oxy-Copeových substrátů silnými zásadami reakci urychluje 1010krát až 1017krát oproti neutrálním podmínkám. Díky tomu bylo umožněno provádět oxy-Copeovy přesmyky i za pokojové teploty, někdy i při 0 °C. K tvorbě plně disociovaného alkoxidu se nejčastěji využívá přídavek hydridu draselného a 18-crown-6.[9]
Výše uvedený diastereomer reaktantu nereaguje, pokud má vinylovou skupinu v ekvatoriální poloze, což naznačuje, že reakce probíhá soustředěným mechanismem. Meziprodukt vykazuje vlastnosti velmi podobné diradikálu. Aniontové Copeovy přesmyky mohou probíhat s velkou účinností i u systémů, které nemají dostatečný překryv orbitalů, což se projevuje například při syntéze periplanonu B, kterou popsali Stuart Schreiber a S. Santini.[10]
K odpovídajícím neutrálním a siloxy-Copeovým přesmykům nedošlo, produkty eliminace se z nich tvořily až při 200 °C.
Ostatní varianty
Byla popsána aza varianta Copeova přesmyku. K významným a často zkoumaným [3,3] sigmatropním reakcím patří také Claisenův přesmyk.
Reference
V tomto článku byl použit překlad textu z článku Cope rearrangement na anglické Wikipedii.
- ↑ Arthur C. Cope; et al.; Journal of the American Chemical Society 1940, 62, 441.
- ↑ Rhoads, S. J.; Raulins, N. R.; Organic Reactions 1975, 22, 1–252. (Review)
- ↑ Hill, R. K.; Compr. Org. Synth. 1991, 5, 785–826.
- ↑ Wilson, S. R.; Org. React. 1993, 43, 93–250. (Review)
- ↑ Michael B. Smith & Jerry March: March's Advanced Organic Chemistry, pp. 1659-1673. John Wiley & Sons, 2007 ISBN 978-0-471-72091-1
- ↑ Williams, R. V., Chem. Rev. 2001, 101 (5), 1185–1204.
- ↑ A Synthesis of Ketones by the Thermal Isomerization of 3-Hydroxy-1,5-hexadienes. The Oxy-Cope Rearrangement Jerome A. Berson, Maitland Jones, , Jr. J. Am. Chem. Soc. 1964; 86(22); 5019–5020. doi:10.1021/ja01076a067
- ↑ Stepwise Mechanisms in the Oxy-Cope Rearrangement Jerome A. Berson and Maitland Jones pp 5017 – 5018; J. Am. Chem. Soc. 1964; doi:10.1021/ja01076a066
- ↑ Evans, D. A.; Golob, A. M. J. Am. Chem. Soc. 1975, 97, 4765–4766. doi:10.1021/ja00849a054
- ↑ Schreiber, S. L.; Santini, S. J. Am. Chem. Soc. 1984, 106, 4038–4039. doi:10.1021/ja00326a028
Externí odkazy
 Obrázky, zvuky či videa k tématu Copeův přesmyk na Wikimedia Commons
Obrázky, zvuky či videa k tématu Copeův přesmyk na Wikimedia Commons
Média použitá na této stránce
Illustrative example of the cope rearrangement.
Vector version of Image:3,3copeexpansion.JPG I made with Inkscape.Autor: Alsosaid1987, Licence: CC BY-SA 4.0
Illustration of dramatic rate acceleration of the anionic oxy-Cope rearrangement.
Autor: Původně soubor načetl Takometer na projektu Wikipedie v jazyce angličtina, Licence: CC BY 2.5
Cope mechanism created by Isaac Yonemoto.
Schreiber












