Coulombická síla

Coulombická síla (také dipól-dipólová síla, dipól-dipólové interakce, Keesomova síla nebo Keesomova interakce) je druh elektrostatické síly, která vzniká mezi permanentními dipóly molekul.
Coulombické síly jsou způsobeny vzájemným působením mezi polárními molekulami, které mají trvalý elektrický dipólový moment. Jejich velikost závisí na vzdálenosti a relativní orientaci dipólu.
Coulombické síly patří mezi tři typy Van der Waalsových sil (Coulombické, indukční a disperzní síly) a jsou z nich nejsilnější. Naopak silnější než Coulombické síly jsou síly mezi ionty v molekulách s iontovou vazbou.
Vodíkové vazby jsou pravděpodobně nejdůležitější z dipólových sil, neboť působí mezi molekulami vody. Důležitou roli však hrají i v dalších anorganických a organických sloučeninách. Současný vědecký výzkum makromolekulárních látek ukazuje jejich klíčový význam pro živé organismy.
Příčiny elektrostatických sil

Příčinou vzniku elektrostatických sil mezi molekulami je polarita chemické vazby mezi atomy, které obsahuje a které mají různou schopnost přitáhnout vazebný elektronový pár.
Polarita chemické vazby je určena rozdílem elektronegativit (∆X) vázaných atomů. Vazebný elektronový pár je vždy více posunut k atomu o větší hodnotě elektronegativity. Vazby rozlišujeme podle rozdílu elektronegativity na:
- nepolární vazby mají rozdíl elektronegativity mezi atomy v rozmezí ∆X = 0,0–0,4 (hustota vazebného elektronového páru je rozložena mezi dvěma vazebnými atomy stejnoměrně);
- polární vazby (kovalentní vazby) mají rozdíl elektronegativity mezi atomy v rozmezí ∆X = 0,4–1,7 (hustota vazebného elektronového páru je rozložena mezi dvěma vazebnými atomy nestejnoměrně, ale stále ještě jsou elektrony sdíleny);
- iontové vazby mají rozdíl elektronegativity vyšší než 1,7 (hustota vazebného elektronového páru mezi dvěma atomy je zcela posunuta k jednomu z atomů. Taková vazba je tvořena dvěma odlišně nabitými ionty).
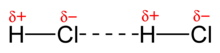
Rozdíl elektronegativit atomů v molekule způsobuje u iontových vazeb trvalý záporný a kladný náboj, u polárních molekul částečný záporný a kladný náboj. Mezi molekulami pak dochází k interakci, která způsobuje, že se stejně nabité konce molekul odpuzují a opačné se naopak přitahují. Jedná se tedy o elektrostatické přitahování opačných nábojů.
Působením těchto sil se molekuly snaží zaujmout pozici s co nejnižší energií, což se někdy označuje jako Keesomův efekt. U kapalin se přitom ustavuje dynamická rovnováha, u krystalů je toto uspořádání molekul stálé.
Příčiny vodíkové vazby

Vodíkové vazby (vodíkové můstky) jsou druhem intermolekulární interakce způsobené dipólovými silami. Jsou silnější formou interakcí dipól-dipól, ale ve srovnání s kovalentními a iontovými vazbami jsou přibližně desetkrát slabší. Mohou se vyskytovat pouze mezi vodíkem a jiným atomem, kterým je nejčastěji kyslík, fluor nebo dusík.
V molekule vody je na atomu kyslíku v důsledku jeho vysoké elektronegativity částečný záporný náboj, zatímco na atomech vodíku kladný. Vzniká tak dipól, který interaguje s dalšími dipóly molekul vody vodíkovým můstkem. Tento stupeň přitažlivosti dává vodě mnoho vlastností nezbytných pro její životně důležitou roli na Zemi.
V makromolekulách vodíková vazba způsobuje, že se makromolekuly skládají do specifického tvaru, který pak hraje důležitou roli pro jejich fyziologické nebo biochemické vlastnosti.

- DNA – dvojitá šroubovicová struktura DNA je z velké části způsobena vodíkovými vazbami mezi páry dusíkatých bází, které spojují jedno komplementární vlákno s druhým.
- Proteiny – vodíkové vazby mezi páteřními kyslíky a amidovými vodíky bílkovin hrají důležitou roli pro jejich sekundární a terciární strukturu. Mají tak vliv na vznik alfa šroubovice nebo beta listu.
- Celulóza – vodíkové vazby jsou důležité pro strukturu celulózy a odvozených polymerů (např. bavlna nebo len).
- Syntetické polymery – mnoho syntetických polymerů obsahuje vodíkové vazby uvnitř a mezi řetězci (např. nylon).
Odkazy
Reference
V tomto článku byly použity překlady textů z článků Dipol-Dipol-Kräfte na německé Wikipedii a Intermolecular force na anglické Wikipedii.
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu Coulombická síla na Wikimedia Commons
Obrázky, zvuky či videa k tématu Coulombická síla na Wikimedia Commons
Média použitá na této stránce
Autor: Thomas Shafee, Licence: CC BY 4.0
The chemical structure of a four base pair fragment of a DNA double helix.
Dipole-dipole interaction between two hydrogen chloride (HCl) molecules
Autor: raster original by Benjah-bmm27
vectorization by B. Jankuloski, Licence: CC0
Hydrogen bonding of water molecules 2D




