Crabtreeův katalyzátor
| Crabtreeův katalyzátor | |
|---|---|
 Strukturní vzorec | |
 Model kationtu | |
| Obecné | |
| Systematický název | hexafluoridofosforečnan (SP-4)-(η²,η²-cyklookta-1,5-dien)(pyridin)(tricyklohexylfosfan)iridný |
| Sumární vzorec | C31H50F6IrNP2 |
| Vzhled | žluté krystaly |
| Identifikace | |
| Registrační číslo CAS | 64536-78-3 |
| PubChem | 15337 |
| SMILES | C1CCC(CC1)P(C2CCCCC2)C3CCCCC3.C1CC=CCCC=C1.C1=CC=NC=C1.F[P-](F)(F)(F)(F)F.[Ir] |
| InChI | 1S/C18H33P.C8H12.C5H5N.F6P.Ir/c1-4-10-16(11-5-1)19(17-12-6-2-7-13-17)18-14-8-3-9-15-18;1-2-4-6-8-7-5-3-1;1-2-4-6-5-3-1;1-7(2,3,4,5)6;/h16-18H,1-15H2;1-2,7-8H,3-6H2;1-5H;;/q;;;-1;/b;2-1-,8-7-;;; |
| Vlastnosti | |
| Molární hmotnost | 804,89 g/mol |
| Teplota tání | 150 °C (423,0 K) (rozkládá se) |
| Bezpečnost | |
| [1] | |
| H-věty | H315 H319 H335[1] |
| P-věty | P261 P264 P271 P280 P302+352 P304+340 P305+351+338 P312 P321 P332+313 P337+313 P362 P403+233 P405 P501[1] |
Některá data mohou pocházet z datové položky. | |
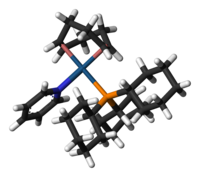
Crabtreeův katalyzátor je komplexní organická sloučenina iridia se vzorcem [C8H12IrP(C6H11)3C5H5N]PF6. Používá se jako homogenní katalyzátor hydrogenačních reakcí a reakcí s přesunem vodíku. Je komerčně dostupný a známý schopností řídit reakce ve prospěch trans-stereoselektivity vůči řídicí skupině.[2][3]
Struktura a příprava
Tento komplex má čtvercovou rovinnou molekulovou geometrii, jak se dá od d8 komplexu očekávat. Připravuje se z dimeru cyklooktadieniridiumchloridu.[4]
Reaktivita
Crabtreeův katalyzátor je účinný při hydrogenacích mono-, di-, tri- a tetrasubstituovaných sloučenin. Zatímco Wilkinsonův a Schrockův–Osbornův katalyzátor nekatalyzují hydrogenace tetrasubstituovaných alkenů, tak Crabtreeův katalyzátor toho je schopen.[2][5]
Frekvence obratu Substrát Wilkinsonův katalyzátor Schrockův–Osbornův katalyzátor Crabtreeův katalyzátor Hex-1-en 650 4000 6400 Cyklohexen 700 10 4500 1-methylcyklohexen 13 — 3800 2,3-dimethyl-but-2-en — — 4000
Katalyzátor je účinný za pokojové teploty.[6] Při reakci není třeba vysoušet rozpouštědlo nebo provádět deoxygenaci vodíku. Lze používat slabě zásadité skupiny, jako jsou estery, ale ne alkoholy nebo aminy.[2] Katalyzátor je citlivý na nečistoty odštěpující protony.[7]
Katalyzátor je nevratně deaktivován po přibližně 10 minutách, což se projeví žlutým zabarvením reakční směsi. Deaktivace je způsobována tvorbou dimerů skrz hydridové můstky.[8] Z těchto důvodů se Crabtreeův katalyzátor obvykle používá v malých množstvích.

Další katalytické využití
Kromě hydrogenačních reakcí lze Crabtreeův katalyzátor použít také u izomerizací a hydroborací alkenů.[6]

Crabtreeův katalyzátor se používá při reakcích vyměňujících izotopy, katalyzuje přímou záměnu protia za deuterium a tritium, bez tvorby meziproduktu.[9]
Bylo zjištěno, že izotopová výměna za použití Crabtreeova katalyzátoru je velmi regioselektivní.[10][11]
Vliv řídicích skupin
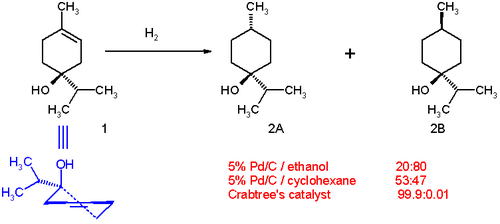
Hydrogenace terpen-4-olů je možné použít jako příklady, jak mohou řídicí skupiny (zde –OH) zprostředkovávat diastereoselektivní hydrogenace. Při použití palladia na uhlíku v ethanolu je poměr produktů 20:80 ve prospěch cis izomeru (2B). S rozpouštědlem interaguje polární část molekuly (obsahující hydroxylovou skupinu), což je způsobeno mírnou haptofilitou, jevem, kdy se funkční skupina váže na povrch heterogenního katalyzátoru a ovlivňuje reakci.[12][13]
V cyklohexanu je rozdělení produktů jiné, 53:47, protože se zde haptofilita nevyskytuje (na molekule cyklohexanu není žádná řídicí skupina). Slouží-li jako rozpouštědlo dichlormethan, tak je reakce posunuta zcela ve prospěch izomeru 2A. Tato selektivita je předvídatelná i prakticky využitelná.[14]
Karbonylové skupiny také mohou řídit hydrogenace za použití Crabtreeova katalyzátoru k vysoké regioselektivitě.[15][16][17]
Řídicí efekt způsobující stereoselektivitu hydrogenace terpen-4-olu za přítomnosti Crabtreeova katalyzátoru je zobrazen níže.

Historie
Crabtree se studentem Georgem Morrisem objevili tento katalyzátor v 70. letech 20. století při práci na iridiových analozích Wilkinsonových rhodiových katalyzátorů na Institut de Chimie des Substances Naturelles v Gif-sur-Yvette nedaleko Paříže.
Předchozími katalyzátory hydrogenací byly například Wilkinsonovy katalyzátory a kationtové rhodné komplexy se dvěma fosfinovými skupinami, které vyvinuli J. A. Osborn a R. Schrock.[18]
Tyto katalyzátory zprostředkovávají hydrogenace skrze odštepování skupin atomů; po adici vodíku na kov se rozpouštědlo nebo fosfinová skupina oddělí od rhodia a alken, který má být hydrogenován, tak může získat přístup k aktivnímu místu.[2] Toto odštěpení probíhá u komplexů rhodia rychle, ovšem téměř se neobjevuje v komplexech iridia.[19]
Z tohoto důvodu byl výzkum soustředěn především na sloučeniny rhodia místo na přechodné kovy třetí řady, jako je iridium. Wilkinson, Osborn a Schrock také jako jediní použili koordinující rozpouštědla.[20]
Crabtree zjistil, že k disociaci ligand u nedochází při heterogenní katalýze, a navrhl, že se tak jedná o omezující krok u homogenní katalýzy.[2] Hledal katalyzátor, který „nevratně vytváří aktivní místa u nekoordinujících rozpouštědel“, což vedlo k objevu Crabtreeova katalyzátoru a použití dichlormethanu (CH2Cl2) jako rozpouštědla.
Reference
V tomto článku byl použit překlad textu z článku Crabtree's catalyst na anglické Wikipedii.
- ↑ a b c https://pubchem.ncbi.nlm.nih.gov/compound/5702647
- ↑ a b c d e Robert H. Crabtree. Iridium compounds in catalysis. Accounts of Chemical Research. 1979, s. 331–337. DOI 10.1021/ar50141a005.
- ↑ J. M. Brown. Directed Homogeneous Hydrogenation. Angewandte Chemie International Edition. 1987, s. 190–203. DOI 10.1002/anie.198701901.
- ↑ R. H. Crabtree; G. E. Morris. Some diolefin complexes of Iridium(I) and a trans-Influence Series for the Complexes [IrCl(cod)L]. Journal of Organometallic Chemistry. 1977, s. 395–403. DOI 10.1016/S0022-328X(00)88091-2.
- ↑ M. White. Hydrogenation [online]. 2002-10-15 [cit. 2014-12-01]. Dostupné v archivu pořízeném dne 2015-01-02.
- ↑ a b CRABTREE, R. H. e-EROS Encyclopedia of Reagents for Organic Synthesis. (1,5-Cyclooctadiene)(tricyclohexylphosphine)(pyridine)iridium(I) Hexafluorophosphate. [s.l.]: [s.n.], 2001. DOI 10.1002/047084289X.rc290m.pub4. (anglicky)
- ↑ Xu Yingjian; D. Michael P. Mingos; John M. Brown. Crabtree’s catalyst revisited; Ligand effects on stability and durability. Chemical Communications. 2008, s. 199–201. DOI 10.1039/b711979h. PMID 18092086.
- ↑ R. Crabtree; H. Felkin; G. Morris. Cationic iridium diolefin complexes as alkene hydrogenation catalysts and the isolation of some related hydrido complexes. Journal of Organometallic Chemistry. 1977, s. 205–215. DOI 10.1016/S0022-328X(00)92273-3.
- ↑ S. Schou. The effect of adding Crabtree's catalyst to rhodium black in direct hydrogen isotope exchange reactions. Journal of Labelled Compounds and Radiopharmaceuticals. 2009, s. 376–381. DOI 10.1002/jlcr.1612.
- ↑ J. Valsborg; L. Sorensen; C. Foged. Organoiridium catalysed hydrogen isotope exchange of benzamide derivatives. Journal of Labelled Compounds and Radiopharmaceuticals. 2001, s. 209–214. DOI 10.1002/jlcr.446.
- ↑ D. Hesk; P. Das; B. Evans. Deuteration of acetanilides and other substituted aromatics using [Ir(COD)(Cy3P)(Py)]PF6 as catalyst. Journal of Labelled Compounds and Radiopharmaceuticals. 1995, s. 497–502. DOI 10.1002/jlcr.2580360514.
- ↑ H. Thompson; R. Naipawer. Stereochemical control of reductions. III. Approach to group haptophilicities. Journal of the American Chemical Society. 1973, s. 6379–6386. DOI 10.1021/ja00800a036.
- ↑ G. Rowlands. Hydrogenation. www.massey.ac.nz. 2002-01-01. Dostupné online [cit. 2014-12-01]. Archivováno 2. 1. 2015 na Wayback Machine.
- ↑ J. Brown. Directed Homogeneous Hydrogenation [New Synthetic Methods (65)]. Angewandte Chemie International Edition in English. 1987, s. 190–203. DOI 10.1002/anie.198701901.
- ↑ A. Schultz; P. McCloskey. Carboxamide and carbalkoxy group directed stereoselective iridium-catalyzed homogeneous olefin hydrogenations. Journal of Organic Chemistry. 1985, s. 5905–5907. DOI 10.1021/jo00350a105.
- ↑ R. H. Crabtree; M. W. Davis. Directing effects in homogeneous hydrogenation with [Ir(cod)(PCy3)(py)]PF6. Journal of Organic Chemistry. 1986, s. 2655–2661. DOI 10.1021/jo00364a007.
- ↑ R. Crabtree; M. Davis. Occurrence and origin of a pronounced directing effect of a hydroxyl group in hydrogenation with [Ir(cod)P(C6H11)3(py)]PF6. Organometallics. 1983, s. 681–682. DOI 10.1021/om00077a019.
- ↑ R. Schrock; J. A. Osborn. Catalytic hydrogenation using cationic rhodium complexes. I. Evolution of the catalytic system and the hydrogenation of olefins. Journal of the American Chemical Society. 1976, s. 2134–2143. DOI 10.1021/ja00424a020.
- ↑ J. A. Osborn; J. Shapley. Rapid intramolecular rearrangements in pentacoordinate transition metal compounds. Rearrangement mechanism of some fluxional iridium(I) complexes. Journal of the American Chemical Society. 1970, s. 6976–6978. DOI 10.1021/ja00726a047.
- ↑ J. Young; G. Wilkinson. The preparation and properties of tris(triphenylphosphine)halogenorhodium(I) and some reactions thereof including catalytic homogeneous hydrogenation of olefins and acetylenes and their derivatives. Journal of the Chemical Society A. 1966, s. 1711. DOI 10.1039/J19660001711.
Externí odkazy
 Obrázky, zvuky či videa k tématu Crabtreeův katalyzátor na Wikimedia Commons
Obrázky, zvuky či videa k tématu Crabtreeův katalyzátor na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Autor: Chemistryproject, Licence: CC BY-SA 4.0
Directing Effects of an OH group on Enantioselectivity of Hydrogenation by Crabtree's Catalyst
Autor: Chemistryproject, Licence: CC BY-SA 4.0
Isomerization with Crabtree's catalyst
chemical structure of Crabtree's catalyst