Cudžiova–Trostova reakce
Cudžiova–Trostova reakce (také nazývaná Trostova allylová alkylace nebo allylová alkylace) je organická substituční reakce, katalyzovaná palladiem, do níž vstupují sloučeniny obsahující odstupující skupiny navázány na allyly. Palladiový katalyzátor se nejprve koordinuje s allylovou skupinou a následně vstupuje do oxidační adice, čímž se vytvoří π-allylový komplex. Tento komplex je následně atakován nukleofilem, čímž vznikne substituovaný produkt.[1]

Tuto reakci objevil Džiró Cudži v roce 1965,[2] roku 1973 do ní Barry Trost zavedl fosfinové ligandy.[3]
Substráty využitelné při této reakci bylynoho různých odstupujících skupin, fosforových, dusíkatých a sirných ligandů i na nejrůznější jiné kovy (i když se stále nejvíce používá palladium).[4]
Zavedení fosfinových ligandů vedlo ke zlepšení reaktivity a objevu asymetrických allylových alkylací. Řada těchto postupů souvisí s objevem chirálních ligandů, pomocí kterých lze často dosáhnout vysoké enantioselektivity a diastereoselektivity za mírných podmínek. Tyto změny výrazně rozšířily využitelnost reakce. Možnosti tvorby vazeb uhlík–uhlík, uhlík–dusík a uhlík–kyslík za takovýchto podmínek způsobily, že je Cudžiova–Trostova reakce často používaná v lékařské chemii a při syntézách přírodních látek.
Historie
V roce 1962 popsal J. Smidt oxidace alkenů na karbonylové sloučeniny katalyzované palladiem. Zjistil, že palladnatý katalyzátor aktivuje alken pro nukleofilní atak hydroxidu.[5] Džiró Cudži poté navrhl, že podobná aktivace by mohla být využita k vytváření nových vazeb uhlík–uhlík.
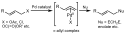
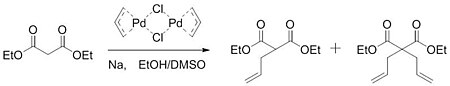
V roce 1965 Cudži tuto domněnku potvrdil. Reakcí dimeru allylpalladiumchloridu se sodnou solí diethylmalonátuvznikala směs monoalkylovaného a dialkylovaného produktu.[6]
Možnosti reakce se nejprve rozšiřovaly pomalu, dokud Barry M. Trost nedosáhl roku 1973 dalšího významného objevu. Při pokusu o přípravu acyklických homologů seskviterpenů narazil na potíže, kdy nebyl schopen alkylovat získané substráty. Tyto potíže byly vyřešeny přidáním trifenylfosfinu do reakční směsi.

Tyto podmínky byly otestovány i na dalších substrátech, přičemž některé reakce probíhaly „za pokojové teploty okamžitě“. Následně zjistil i to, jak se dají tyto ligandy použít k asymetrické syntéze.[7] Následně se rozběhl další výzkum allylové alkylace , jenž vedl k dnešní významnosti této reakce.
Mechanismus
Při použití sloučenin Pd0 a substrátů obsahujících odstupující skupiny v allylových pozicích Cudžiova–Trostova reakce má následující katalytický cyklus:

Nejprve se palladium koordinuje na alken za vzniku η2 l-Pd0 pí komplexu. Následuje oxidační adice, při níž nastane oddělení odstupující skupiny a inverze konfigurace za tvorby η3 π-allyl-Pd2+ pí komplexu. Nukleofil se poté naváže na allylovou skupinu, čímž dojde k obnovení η2 π-allyl-Pd0 komplexu. Cyklus je dokončen odštěpením palladia z alkenu, čímž se obnoví katalyzátor.[8]
„Tvrdé“ a „měkké“ nukleofily
Používané nukleofily se obvykle připravují z prekurzorů (pronukleofilů) před samotným použitím, a to deprotonací zásadou.[9] Tyto nukleofily se dále dělí na „tvrdé“ a „měkké“ na základě pKa příslušných konjugovaných kyselin. „Tvrdé“ nukleofily mají obvykle konjugované kyseliny s pKa vyššími než 25, zatímco u „měkkých“ nukleofilů bývají tyto hodnoty nižší než 25.[10]
Dělení nukleofilů na tvrdé a měkké má význam, protože má vliv na stereoselektivitu produktu. „Měkké“ nukleofily obracejí stereochemii π-allylového komplexu. Tato inverze společně s inverzí stereochemie při oxidační adici palladia vyústí v zachování stereochemie. Při použití „tvrdých“ nukleofilů se stereochemie π-allylového komplexu zachovává a ve výsledku dochází k inverzi stereochemie.[11]
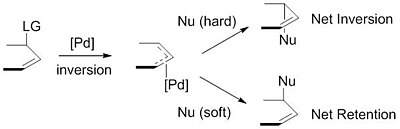
Tuto vlastnost lze vysvětlit mechanismy nukleofilního ataku. „Měkké“ nukleofily atakují uhlík allylové skupiny, zatímco „tvrdé“ atakují kovové centrum s následnou redukční eliminací.[12]
Fosfinové ligandy
Fosfinové lkigandy, například trifenylfosfin nebo Trostův ligand, rozšiřují možnosti Cudžiovy–Trostovy reakce. Mohou pozměňovat vlastnosti palladiových katalyzátorů, například sterické a elektronové. Také mohou zavádět chiralitu do výsledného produktu, což umožňuje enantioselektivní provedení reakce.
Asymetrické allylové substituce
Enantioselektivní Cudžiovy–Trostovy reakce (Trostovy asymetrické allylové alkylace nebo asymetrické allylové alkylace). Jsou často využívané při asymetrických syntézách.[13][14][15] Reakce byla původně vyvinuta pro palladiový katalyzátor navázaný na Trostův ligand, spektrum vhodných reakčních podmínek se však značně rozšířilo. Enantioselektivitu lze zavést v kterékoliv části procesu kromě dekomplexace palladia z alkenu, protože stereocentrum je již v daném místě nastaveno. Bylo vyvinuto pět hlavních postupů využití těchto možností a provedení enantioselektivní reakce:
- Přednostní ionizace enantioselektivní komplexací alkenů
- Enantiotopní ionizace odstupujících skupin
- Atak na enantioselektivních koncích allylového komplexu
- Enantioselektivní výměna stran u π-allylového komplexu
- Diferenciace prochirálních stran nukleofilu
Nejvhodnější postup závisí hlavně na použitém substrátu, v některých případech lze použít více těchto metod.
Rozsah
Nukleofily
Při Cudžiových–Trostových reakcích lze s dobrými výsledky použít mnoho různých nukleofilů. K nejčasějším patří estery kyseliny malonové, enoláty, primární alkoxidy, karboxyláty, fenoxidy, aminy, azidy, sulfonamidy, imidy a sulfony.
Odstupující skupiny
I spektrum možných odstupujících skupin je široké, nejvíce se využívají estery kyseliny uhličité, fenoly, organofosfáty, organohalogenidy a karboxyláty.
„Tvrdé“ a „měkké“ nukleofily
Rozsah použitelných měkkých nukleofilů lze rozšířit na pronukleofily s pKa mnohem vyššími než ~ 25. Některé z nich mají pKa okolo 32,[16] existují však ještě zásaditější pronukleofily (pKa ~ 44), které mohou po přidání Lewisovy kyseliny usnadnit deprotonaci.[17] Upravené rozmezí pKa měkkých nukleofilů je významné tím, že tyto nukleofily byly po delší dobu jedinými známými[18][19] použitelnými nukleofily[20] (i když byly známy neenantioselektivní reakce tvrdých nukleofilů[21]). Rozšířením záběru využitelných měkkých nukleofilů bylo možné tyto substráty zapojit do enantioselektivních reakcí využívajících dobře popsané postupy.
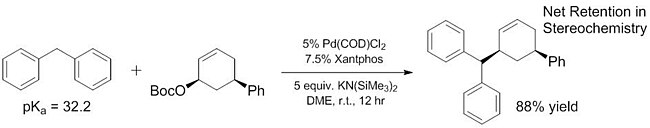
Ligandy
Za účelem vylepšení reaktivity trifenylfosfinových ligandů pro allylové alkylace se jejich struktury brzy staly složitějšími. Ligandy mohou obsahovat atomy fosforu, síry či dusíku, i jejich kombinace, většina studií se však zaměřila na monofosfinové a difosfinové; ty lze dále dělit podle druhu jejich chirality, přičemž některé ligandy obsahují centrální chiralitu na atomech fosforu nebo uhlíku, zatímco další mají biarylové axiální a jiné rovinné chirality.
Difosfiny s centrální chiralitou zahrnují například Trostův ligand.[22]
Fosfinooxazolinové ligandy se nejlépe uplatňují při reakcích uhlíkatých nukleofilů.[23]
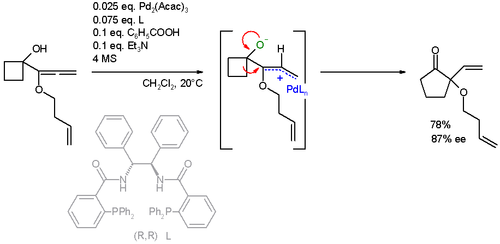
Další substráty
Jako substráty allylových alkylací mohou být rovněž použity alleny. Při následujícím rozšiřování kruhu byl také využit Wagnerův–Meerweinův přesmyk:[24] Kokatalyzátory byly kyselina benzoová a triethylamin. Hydrolýze zabraňovalo molekulární síto.
Využití
Syntéza léčiv a přírodních látek
Možnost vytvářet pomocí Cudžiových–Trostových reakcí vazby uhlík–uhlík, uhlík–dusík a uhlík–kyslík enantioselektivně za mírných podmínek způsobuje, že jsou reakce běžnými součástmi příprav složitějších molekul.
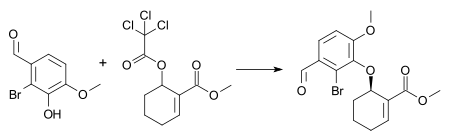
Jako příklad lze uvést přípravu meziproduktu kombinované totální syntézy galantaminu a morfinu[25] za použití 1 molárního procenta (mol %) dimeru [pi-allylpalladium chloridu], 3 mol % (S,S)- Trostova ligandu a triethylaminu v dichlormethanu jako rozpouštědlu za pokojové teploty. Dochází přitom ke tvorbě (−)-enantiomeru aryletheru s výtěžností 72 % a 88% enantiomerním přebytkem.
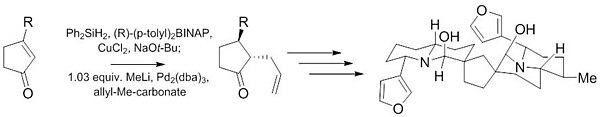
Jiná Cudžiova–Trostova reakce je součástí prvních kroků přípravy (−)-neothiobinufaridinu. Tímto se ukazuje možnost použití uvedené reakce k získání vysoce diastereoselektivních (10:1) a enantioselektivních (97.5:2.5) produktů z nechirálních výchozích látek s použitím velmi malého množství katalyzátoru, okolo 1mol %.[26]
Detekce palladia
Mimo lékařskou chemii a přípravu přírodních látek lze Cudžiovu–Trostovu reakci také použít k důkazu přítomnosti palladia. Detekční soustava se skládá z nefluorescenčního senzoru odvozeného od fluoresceinu (byly také vyvinuty senzory pro delší vlnové délky[27]), který fluoreskuje pouze za přítomnosti palladia nebo platiny. Tato citlivost na palladium či platinu je založena na Cudžiově–Trostově reakci. Senzor obsahuje allylovou skupinu a fluorescein sloužící jako odstupující skupina. Vzniká π-allylový komplex a po ataku nukleofilu se uvolní fluorescein, což vede k prudkému nárůstu intenzity fluorescence.[28][29]

Tento jednoduchý způsob detekce palladia pomocí fluorescence se osvědčil při zkoumání obsahu palladia v rudách kovů,[30] lécích[31] i živých buňkách.[32]
S rostoucím používáním reakcí katalyzovaných palladiem se tato rychlá detekce stala velmi vhodnou k omezení znečištění léků a životního prostředí palladiem a platinou.
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Tsuji–Trost reaction na anglické Wikipedii.
- ↑ Strategic Applications of Named Reactions in Organic Synthesis by Laszlo Kurti, Barbara Czako ISBN 0-12-429785-4
- ↑ Jiro Tsuji; Hidetaka Takahashi; Masanobu Morikawa. Organic syntheses by means of noble metal compounds XVII. Reaction of π-allylpalladium chloride with nucleophiles. Tetrahedron Letters. 1965, s. 4387–4388. ISSN 0040-4039. DOI 10.1016/s0040-4039(00)71674-1.
- ↑ Trost, B. M.; Fullerton, T. J. "New synthetic reactions. Allylic alkylation." Journal of the American Chemical Society 1973, 95, 292–294. DOI:10.1021/ja00782a080.
- ↑ Rios, Itzel Guerrero; Rosas-Hernandez, Alonso; Martin, Erika; "Recent Advances in the Application of Chiral Phosphine Ligands in Pd-Catalysed Asymmetric Allylic Alkylation." Molecules, 2011, 16 970–1010. DOI:10.3390/molecules16010970
- ↑ Smidt, J., Hafner, W., Jira, R., Sieber, R., Sedlmeier, J. and Sabel, A. (1962), Olefinoxydation mit Palladiumchlorid-Katalysatoren. Angewandte Chemie, 74: 93–102. DOI:10.1002/ange.19620740302
- ↑ Organic syntheses by means of noble metal compounds XVII. Reaction of Šablona:Pi-allylpalladium chloride with nucleophiles Tetrahedron Letters, volume 6, issue 49, 1965, pages 4387–4388 Jiro Tsuji, Hidetaka Takahashi, Masanobu Morikawa DOI:10.1016/S0040-4039(00)71674-1
- ↑ Asymmetric Transition Metal-Catalyzed Allylic Alkylations Barry M. Trost David L. Van Vranken Chem. Rev., 1996, 96 (1), pp 395–422 DOI:10.1021/cr9409804
- ↑ Barry M. Trost; Ting Zhang; Joshua D. Sieber. Catalytic asymmetric allylic alkylation employing heteroatom nucleophiles: a powerful method for C–X bond formation. Chemical Science. 2010, s. 427. ISSN 2041-6520. DOI 10.1039/c0sc00234h.
- ↑ Strategic Applications of Named Reactions in Organic Synthesis (Paperback) by Laszlo Kurti, Barbara Czako ISBN 0-12-429785-4
- ↑ Barry M. Trost; David A. Thaisrivongs. Strategy for Employing Unstabilized Nucleophiles in Palladium-Catalyzed Asymmetric Allylic Alkylations. Journal of the American Chemical Society. 2008-10-01, s. 14092–14093. ISSN 0002-7863. DOI 10.1021/ja806781u. PMID 18826305.
- ↑ Marco Luparia; Maria Teresa Oliveira; Davide Audisio; Frédéric Frébault; Richard Goddard; Nuno Maulide. Catalytic Asymmetric Diastereodivergent Deracemization. Angewandte Chemie International Edition. 2011-11-04, s. 12631–12635. ISSN 1433-7851. DOI 10.1002/anie.201106321. PMID 22058047.
- ↑ B. M. Trost, T. R. Verhoeven, J. M. Fortunak, Tetrahedron Letters 1979, 20, 2301 – 2304
- ↑ Trost, B. M.; Dietsch, T. J. "New synthetic reactions. Asymmetric induction in allylic alkylations." J. Am. Chem. Soc. 1973, 95, 8200–8201. DOI:10.1021/ja00805a056
- ↑ Trost, B. M.; Strege, P. E. "Asymmetric induction in catalytic allylic alkylation." J. Am. Chem. Soc. 1977, 99, 1649–1651. DOI:10.1021/ja00447a064.
- ↑ Asymmetric Transition-Metal-Catalyzed Allylic Alkylations:Applications in Total Synthesis Trost, B. M.; Crawley, M. L. Chem. Rev.; 2003; 103(8); 2921–2944 DOI:10.1021/cr020027w
- ↑ Sha, Sheng-Chun; Zhang, Jiadi; Carroll, Patrick J.; Walsh, Patrick J.; "Raising the pKa Limit of "Soft" Nucleophiles in Palladium-Catalyzed Allylic Substitutions: Application of Diarylmethane Pronucleophiles." JACS 2013, 135, 17602–17609. doi: 10.1021/ja409511n
- ↑ ZHANG, Jiadi; STANCIU, Corneliu; WANG, Beibei; HUSSAIN, Mahmud M.; DA, Chao-Shan; CARROLL, Patrick J.; DREHER, Spencer D. Palladium-Catalyzed Allylic Substitution with (η6-Arene–CH2Z)Cr(CO)3-Based Nucleophiles. Journal of the American Chemical Society. American Chemical Society (ACS), 29 November 2011, s. 20552–20560. ISSN 0002-7863. DOI 10.1021/ja208935u. PMID 22047504.
- ↑ TROST, B. M.; TOSTE, F. D. Regio- and Enantioselective Allylic Alkylation of an Unsymmetrical Substrate: A Working Model. Journal of the American Chemical Society. American Chemical Society (ACS), 30 April 1999, s. 4545–4554. ISSN 0002-7863. DOI 10.1021/ja9828713.
- ↑ TROST, Barry M.; MACHACEK, Michelle R.; APONICK, Aaron. Predicting the Stereochemistry of Diphenylphosphino Benzoic Acid (DPPBA)-Based Palladium-Catalyzed Asymmetric Allylic Alkylation Reactions: A Working Model. Accounts of Chemical Research. 26 July 2006, s. 747–760. ISSN 0001-4842. DOI 10.1021/ar040063c. PMID 17042475.
- ↑ LI, Xiao-Hui; ZHENG, Bao-Hui; DING, Chang-Hua; HOU, Xue-Long. Enantioselective Synthesis of 2,3-Disubstituted Indanones via Pd-Catalyzed Intramolecular Asymmetric Allylic Alkylation of Ketones. Organic Letters. 8 November 2013, s. 6086–6089. ISSN 1523-7060. DOI 10.1021/ol402980v. PMID 24206052.
- ↑ Castanet, Y.; Petit, F. Tetrahedron Letters 1979, 20, 3221.
- ↑ LU, Zhan; MA, Shengming. Metal-Catalyzed Enantioselective Allylation in Asymmetric Synthesis. Angewandte Chemie International Edition. 2008, s. 258–297. ISSN 1433-7851. DOI 10.1002/anie.200605113. PMID 17968865.
- ↑ BEHENNA, Douglas C.; STOLTZ, Brian M. The Enantioselective Tsuji Allylation. Journal of the American Chemical Society. American Chemical Society (ACS), 28 October 2004, s. 15044–15045. ISSN 0002-7863. DOI 10.1021/ja044812x. PMID 15547998.
- ↑ Trost, B. M.; Xie, J. "Palladium-Catalyzed Asymmetric Ring Expansion of Allenylcyclobutanols: An Asymmetric Wagner–Meerwein Shift." J. Am. Chem. Soc. 2006, 128, 6044–6045. DOI:10.1021/ja0602501.
- ↑ Trost, B. M.; Tang, W.; Toste, F. D. "Divergent Enantioselective Synthesis of (−)-Galantamine and (−)-Morphine." J. Am. Chem. Soc. 2005, 127, 14785–14803. DOI:10.1021/ja054449+
- ↑ Daniel J. Jansen; Ryan A. Shenvi. Synthesis of (−)-Neothiobinupharidine. Journal of the American Chemical Society. 2013-01-11, s. 1209–1212. ISSN 0002-7863. DOI 10.1021/ja310778t. PMID 23298203.
- ↑ WANG, Zhifei; ZHENG, Shuang; CAI, Jin; WANG, Peng; FENG, Jie; YANG, Xia; ZHANG, Liming. Fluorescent Artificial Enzyme-Linked Immunoassay System Based on Pd/C Nanocatalyst and Fluorescent Chemodosimeter. Analytical Chemistry. 20 November 2013, s. 11602–11609. ISSN 0003-2700. DOI 10.1021/ac403001y. PMID 24160777.
- ↑ Amanda L. Garner; Kazunori Koide. Studies of a fluorogenic probe for palladium and platinum leading to a palladium-specific detection method. Chemical Communications. 2009, s. 86–88. ISSN 1359-7345. DOI 10.1039/b814197e. PMID 19082007.
- ↑ Fengling Song; Amanda L. Garner; Kazunori Koide. A Highly Sensitive Fluorescent Sensor for Palladium Based on the Allylic Oxidative Insertion Mechanism. Journal of the American Chemical Society. 2007-09-21, s. 12354–12355. ISSN 0002-7863. DOI 10.1021/ja073910q. PMID 17887672.
- ↑ Jessica M. Williams; Kazunori Koide. A High-Throughput Method To Detect Palladium in Ores. Industrial & Engineering Chemistry Research. 2013-06-18, s. 8612–8615. ISSN 0888-5885. DOI 10.1021/ja073910q. PMID 17887672.
- ↑ Xiaodong Bu; Kazunori Koide; Evan J. Carder; Christopher J. Welch. Rapid Analysis of Residual Palladium in Pharmaceutical Development Using a Catalysis-Based Fluorometric Method. Organic Process Research & Development. 2012-12-28, s. 8612–8615. ISSN 1083-6160. DOI 10.1021/op3003008.
- ↑ ZHU, Baocun; GAO, Chenchen; ZHAO, Yunzhou; LIU, Caiyun; LI, Yamin; WEI, Qin; MA, Zhenmin. A 4-hydroxynaphthalimide-derived ratiometric fluorescent chemodosimeter for imaging palladium in living cells. Chemical Communications. 2011, s. 8656–8658. ISSN 1359-7345. DOI 10.1039/c1cc13215f. PMID 21725576.
Externí odkazy
 Obrázky, zvuky či videa k tématu Cudžiova-Trostova reakce na Wikimedia Commons
Obrázky, zvuky či videa k tématu Cudžiova-Trostova reakce na Wikimedia Commons - Org. Synth. 1989, 67, 105
- Org. Synth. 2009, 86, 47
- Příklad využití Cudžiovy–Trostovy reakce při totální syntéze : http://www.biocis.u-psud.fr/IMG/pdf/concise_total_synthesis_of_Minfiensine.pdf Archivováno 4. 3. 2016 na Wayback Machine. jedná se o druhou reakci na adrese: http://www.biocis.u-psud.fr/spip.php?article332 Archivováno 26. 4. 2012 na Wayback Machine.
Média použitá na této stránce
Tsuji-Trost reaction / allylation Trost allylation
Autor: Dissolution, Licence: CC BY-SA 3.0
Trost AAA galanthamine Intermediate
Autor: Mstreeter15, Licence: CC BY-SA 3.0
Stereochemical Outcome of "Hard" vs. "Soft" Nucleophilic Attack
Autor: Dontbelievethelies1, Licence: CC BY-SA 4.0
Catalytic cycle of the Tsuji-Trost reaction