Cyklohexenon
| Cyklohexenon | |
|---|---|
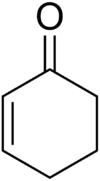 strukturní vzorec | |
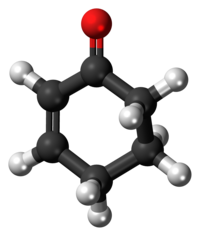 model molekuly | |
| Obecné | |
| Systematický název | Cyklohex-2-en-1-on |
| Anglický název | cyclohexenone |
| Sumární vzorec | C6H8O |
| Vzhled | bezbarvá nebo nažloutlá kapalina |
| Identifikace | |
| Registrační číslo CAS | 930-68-7 |
| PubChem | 13594 |
| ChEBI | 15977 |
| SMILES | C1CC=CC(=O)C1 |
| InChI | 1/C6H8O/c7-6-4-2-1-3-5-6/h2,4H,1,3,5H2 |
| Vlastnosti | |
| Molární hmotnost | 96,127 g/mol |
| Teplota tání | −53 °C (220 K) |
| Teplota varu | 171 až 173 °C (444 až 446 K) |
| Rozpustnost ve vodě | 4,13 g/100 ml |
| Rozpustnost v polárních rozpouštědlech | rozpustný v alkoholech a aprotických polárních rozpouštědlec |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v etherech, esterech a halogenalkanech |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R10 R22 R23/24 R36/37/38 |
| S-věty | S20 S27 S36/37/39 S45 S60 |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Cyklohexenon (cyklohex-2-en-1-on) je organická sloučenina, která patří mezi ketony, konkrétně mezi enony. Jedná se o užitečný meziprodukt při syntéze různých látek jako jsou léčiva a vůně.[2] V čisté podobě to je čirá bezbarvá kapalina, ovšem komerční produkty jsou zpravidla nažloutlé.
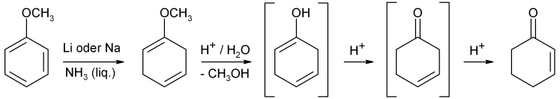
Průmyslově se vyrábí z fenolu Birchovou redukcí.[3]
Běžné reakce cyklohexenonu jsou nukleofilní konjugovaná adice s organoměďnatými činidly, Michaelovy reakce a Robinsonovy anelace.[4][5]
Vlastnosti
Cyklohexen je rozpustný v mnoha rozpouštědlech jako jsou alkoholy, ethery, halogenuhlovodících, esterech a rovněž v aprotických polárních rozpouštědlech.
Cyklohexenon reaguje s ketony i alkeny. Jako typický zástupce α,β-nenasycených karbonylových sloučenin má nízkou elektronovou hustotu na uhlíkových atomech tvořících dvojnou vazbu.
Při reakci se silnými zásadami dochází k deprotonaci na čtvrtém a šestém uhlíkovém atomu.
Výroba
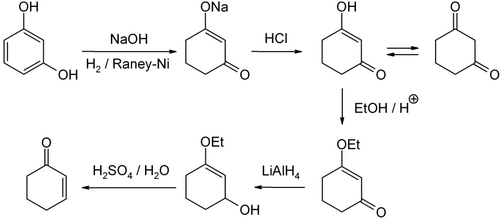
Existuje několik různých způsobů výroby cyklohexenonu. V laboratořích se používá redukce 3-ethoxy-2-cyklohexen-1-onu a následně kyselá hydrolýza vzniklého produktu. Prekurzor lze získat z 1,3-cyklohexandionu, který se zase připraví z resorcinolu.
Jako výchozí surovinu lze rovněž použít anisol. Cyklohexenon se z něj získá Birchovou redukcí následovanou kyselou hydrolýzou.
Dalšími možnostmi jsou příprava z cyklohexanonu α-bromací a eliminací a rovněž z 3-chlorcyklohexenu hydrolýzou a oxidací.
Průmyslově se cyklohex-2-en-1-on vyrábí katalytickou oxidací cyklohexenu, například peroxidem vodíku za přítomnosti katalytzátorů s obsahem vanadu. Bylo vyvinuto několik, patentovaných, postupů s různými oxidačními činidly a katalyzátory.
Použití
Cyklohexenon je látkou často používanou v organické syntéze, jelikož umožňuje mnoho způsobů rozšiřování molekul. Snadno u něj probíhá Michaelova adice s nukleofily (například enoláty či silylenolethery); lze jej rovněž zapojit do Dielsovy–Alderovy reakce s dieny s vysokou elektronovou hustotou. Též reaguje s organoměďnatými sloučeninami 1,4 adicí (Michaelovou adicí) či s Grignardovými činidly 1,2 adicí. Využívá se také při syntéze polycyklických přírodních látek.
Roku 1986 bylo náhodou zjištěno, že cyklohexenon působí jako in-vitro katalyzátor dekarboxylace alfa-aminokyselin.[6] Japonští výzkumníci zkoumali využití ditercbutylperoxidu jako katalyzátoru dekarboxylace za použití cyklohexanolu jako rozpouštědla, ovšem zjistili, že když použili méně čistý (tedy technický, 98%) cyklohexanol, reakce probíhala asi čtyřikrát rychleji než při použití čistšího cyklohexanolu (>99,3%). Následně zjistili, že cyklohexanol obsahoval cyklohexenon jako nečistotu, která byla v technické látce přítomna ve třikrát větší koncentraci (přibližně 0,3 % oproti 0,1 %). Dalším výzkumem bylo zjištěno, že 1% roztok cyklohexenonu v cyklohexanolu dekarboxyluje většinu aminokyselin, včetně neobvyklých, s výtěžností 80-95 % během několika hodin. Výjimkami jsou například histidin, kde reakce trvala přes 26 hodin, a polyaminokyseliny, u nichž k dekarboxylaci při použití cyklohex-2-en-1-onu vůbec nedošlo a je třeba hledat jiné způsoby.[7]
Reference
V tomto článku byl použit překlad textu z článku Cyclohexenone na anglické Wikipedii.
- ↑ a b 2-Cyclohexen-1-one. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ Podraze, K.F. Org. Prep. Proced. Int., 1991, 23, p. 217.
- ↑ Organic Building Blocks of the Chemical Industry, Harry H. Szmant, ISBN 978-0-471-85545-3
- ↑ Michael G. Organ and Paul Anderson. Carbonyl and Conjugate Additions to Cyclohexenone: Experiments Illustrating Reagent Selectivity. Journal of Chemical Education. 1996, s. 1193. DOI 10.1021/ed073p1193. (anglicky)
- ↑ Tetrahedron Lett. 34, 3881, (1993)
- ↑ HASHIMOTO, M; EDA, Y; YASUTOMO, O; TOSHIAKI, I; AOKI, S. A novel decarboxylation of .ALPHA.-amino acids. A facile method of decarboxylation by the use of 2-cyclohexen-1-one as a catalyst.. Chemistry Letters. 1986, s. 893–896. Dostupné online [cit. 4 January 2016]. DOI 10.1246/cl.1986.893. (anglicky)
- ↑ LAVAL, G; GOLDING, B. One-pot Sequence for the Decarboxylation of α-Amino Acids. Synlett. 2003, s. 542–546. Dostupné online [cit. 4 January 2016]. DOI 10.1055/s-2003-37512. (anglicky)
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for toxic substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
chemical structure of cyclohexenone
Birch-Reduktion von Anisol mit anschließender Weiterreaktion unter sauren Bedingungen.
(selbst erstellt mit MDL ISIS Draw)
Autor: Jynto (talk), Licence: CC0
Ball-and-stick model of the cyclohexenone molecule, a cyclic ketone.
Colour code:
- Carbon, C: black
- Hydrogen, H: white
- Oxygen, O: red
Synthese von 2-Cyclohexen-1-on, ausgehend von Resorcin
(selbst erstellt mit MDL® ISISDraw)