Cyklooktatetraen
| Cyklooktatetraen | |
|---|---|
 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | cyklookta-1,3,5,7-tetraen |
| Ostatní názvy | [8]annulen |
| Sumární vzorec | C8H8 |
| Vzhled | bezbarvá kapalina[1] |
| Identifikace | |
| Registrační číslo CAS | 629-20-9 |
| EC-no (EINECS/ELINCS/NLP) | 211-080-3 |
| PubChem | 637866 |
| SMILES | C1=CC=CC=CC=C1 |
| InChI | InChI=1S/C8H8/c1-2-4-6-8-7-5-3-1/h1-8H/b2-1-,3-1?,4-2?,5-3-,6-4-,7-5?,8-6?,8-7- |
| Vlastnosti | |
| Molární hmotnost | 104,158 g/mol |
| Teplota tání | −4,7 °C (268,4 K)[1] |
| Teplota varu | 140,5 °C (413,6 K)[1] |
| Hustota | 0,925 g/cm3 |
| Rozpustnost ve vodě | nemísitelný |
| Bezpečnost | |
| [1] | |
| H-věty | H225 H304 H315 H319 H335[1] |
| P-věty | P210 P233 P240 P241 P242 P243 P261 P264 P271 P280 P301+310 P302+352 P303+361+353 P304+340 P305+351+338 P312 P321 P331 P332+313 P337+313 P361 P362 P370+378 P403+233 P403+235 P405 P501[1] |
Některá data mohou pocházet z datové položky. | |
Cyklooktatetraen nebo cyklookta-1,3,5,7-tetraen (COT) je nenasycený cyklický uhlovodík se vzorcem C8H8; za pokojové teploty bezbarvá až nažloutlá kapalina. Vzhledem ke své stechiometrické podobnosti s benzenem se stal předmětem výzkumu i řady sporů.
Na rozdíl od benzenu cyklooktatetraen není aromatický; tuto vlastnost však má jeho dianion, C8H 2-
8 (nazývaný cyklooktatetraenid). Reaktivita tohoto uhlovodíku odpovídá běžným polyenům, například se účastní adičních reakcí; u benzenu jsou oproti tomu běžné substituční reakce.
Historie
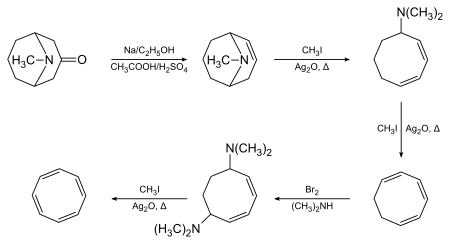
Cyklooktatetraen-1,3,5,7-tetraen poprvé připravil Richard Willstätter v roce 1905 Hofmannovou eliminací pseudopelletierinu:[2][3]
Willstätter zjistil, že se u vzniklé sloučeniny neobjevuje očekávaná aromaticita. Mezi roky 1939 a 1943 se několik chemiků neúspěšně pokusilo o její přípravu; zjistilo se, že vytvořili izomerní styren. Během 2. světové války Walter Reppe vyvinul jednokrokovou jednoduchou syntézu cyklooktatetraenu z acetylenu, tedy stejného materiálu, jaký použil Willstätter.[4]
Pochyby o přesnosti Willstätterovy syntézy byly zažehnány, když ji Arthur C. Cope se svými spolupracovníky roku 1947 plně zopakoval s použitím původních postupů. Získal stejný cyklooktatetraen[5] a provedl spektrální analýzy řady meziproduktů, čímž přesnost Willstätterova postupu dále potvrdil.[6]
Struktura

Už při prvních studiích se ukázalo, že reaktivita cyklooktatetraenu neodpovídá chemii aromatických sloučenin.[7]
Následně experimenty založené na elektronové difrakci ukázaly, že délky všech vazeb C-C jsou stejné.[8]
Data z rentgenové difrakce, která poskytl H. S. Kaufman, ovšem ukázala, že cyklooktatetraen zaujímá několik konformací a má dvě různé délky vazeb C–C.[9]
Zjistilo se tak, že jde o anulen, ve kterém se střídají jednoduché a dvojné vazby mezi atomy uhlíku.
V základním stavu nejde o rovinnou molekulu; úhel C=C−C je 126,1° a C=C−H činí 117,6°.[10] Bodová grupa cyklooktatetraenu je D2d.[11]
Z rovinných přechodných stavů je D4h v důsledku Jahnova–Tellerova efektu stabilnější než D8h.[12]
Příprava
Původní Willstätterova syntéza (posloupnost čtyř eliminačních reakcí na cyklooktanu) má nízkou výtěžnost. Reppeova syntéza z acetylenu za vysokého tlaku a přítomnosti horké směsi kyanidu nikelnatého a karbidu vápenatého, se vyznačuje výrazně lepší výtěžností, okolo 90 %:[4]
Další možností je fotolýza barrelenu, jenž je s cyklooktatetraenem strukturně izomerní, meziproduktem je přitom další izolovatelný izomer, semibulvalen.[13]
Deriváty cyklooktatetraenu je rovněž možné získat skrz semibulvalenové meziprodukty. V níže zobrazené posloupnosti reakcí se vytváří oktaethylcyklooktatetraen (C8Et8) tepelnou izomerizací oktaethylsemibulvalenu, jenž vzniká cyklodimerizací 1,2,3,4-tetraethyl-1,4-dilithio-buta-1,3-dienu za přítomnosti bromidu měďného.[14]
Protože je cyklooktatetraen nestálý a snadno vytváří výbušné organické peroxidy, tak se do komerčních vzorků obvykle přidávají malá množství hydrochinonu. Opakovaně otevírané lahve mohou kolem hrdla mít bílé krystalky peroxidu, které mohou v důsledku mechanického působení vybouchnout.
Výskyt
Cyklooktatetraen byl izolován z některých hub.[15]
Reakce
Vazby π v COT reagují podobně jako u alkenů. Reakcemi COT s peroxykyselinami nebo dimethyldioxiranem vznikají epoxidy; známo je také mnoho dalších adicí. Polymerizací s otvíráním kruhu z cyklooktatetraenu lze získat polyacetylen.[16]
COT i jeho analogy s postranními řetězci je možné použít na přípravu ligandů a sendvičových sloučenin.
Cyklooktatetraen též vstupuje do přesmykových reakcí, jimiž vznikají areny, například oxidací vodným roztokem síranu rtuťnatého vzniká fenylacetaldehyd[4][17] a fotochemickým přesmykem monoepoxidu COT se vytváří benzofuran.[18]
Cyklooktatetraenid jako ligand a prekurzor ligandů

COT snadno reaguje s draslíkem za vzniku soli K2COT, obsahující dianion C8H 2−
8 .[19]
Dianion je rovinný, osmistěnný a s 10 π elektrony také aromatický.
Cyklooktatetraen vytváří komplexy s některými kovy, jako jsou yttrium, lanthanoidy a aktinoidy.[20] Uranocen, (U(COT)2), obsahuje dva η8-COT ligandy. U bis(cyklooktatetraen)železa (Fe(COT)2) je jeden COT η6 a druhý η4. Trikarbonyl (cyklooktatetraen)železa obsahuje η4-COT. 1H-NMR spektra těchto komplexů ukazují, že jsou singletové.[21]

Cyklooktatetraen lze chlorovat za vzniku [4.2.0]-bicyklické sloučeniny, která dále vstupuje do Dielsovy–Alderovy reakce s dimethylacetylendikarboxylátem. Poté se může retro-Dielsovou–Alderovou reakcí při 200 °Cuvolnit cis-dichlorcyklobuten.
Cyklooktatetraen také reaguje s nonakarbonylem diželeza na trikarbonyl (cyklobutadien)železa.[22][23]
Odkazy
Související články
- Cyklobutadien
- Pentalen
- Barrelen, strukturní izomer cyklooktatetraenu
- Heptafulven, strukturní izomer cyklooktatetraenu
- Semibulvalen
- Benzen
Externí odkazy
 Obrázky, zvuky či videa k tématu Cyklooktatetraen na Wikimedia Commons
Obrázky, zvuky či videa k tématu Cyklooktatetraen na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku Cyclooctatetraene na anglické Wikipedii.
- ↑ a b c d e f https://pubchem.ncbi.nlm.nih.gov/compound/637866
- ↑ S. Mason. The Science and Humanism of Linus Pauling (1901−1994). Chemical Society Reviews. 1997, s. 29–39. DOI 10.1039/CS9972600029.
- ↑ Richard Willstätter; Ernst Waser. Über Cyclo-octatetraen. Berichte der Deutschen Chemischen Gesellschaft. 1911, s. 3423–3445. Dostupné online. DOI 10.1002/cber.191104403216.
- ↑ a b c Walter Reppe; Otto Schlichting; Karl Klager; Tim Toepel. Cyclisierende Polymerisation von Acetylen. I. Über Cyclooctatetraen. Justus Liebigs Annalen der Chemie. 1948, s. 1–92. DOI 10.1002/jlac.19485600102.
- ↑ Arthur C. Cope; C. G. Overberger. The synthesis of cycloöctatetraene from pseudopelletierine. Journal of the American Chemical Society. 1947, s. 976. DOI 10.1021/ja01196a513. PMID 20292490.
- ↑ Arthur C. Cope; C. G. Overberger. Cyclic Polyolefins. I. Synthesis of Cyclooctatetraene from Pseudopelletierine. Journal of the American Chemical Society. 1947, s. 1433–1437. DOI 10.1021/ja01184a041. PMID 18915758.
- ↑ A. W. Johnson. Organic Chemistry. Science Progress. 1947, s. 506–515.
- ↑ O. Bastiensen; O. Hassel; A. Langseth. The 'Octa-Benzene', Cyclo-octatetraene (C8H8). Nature. 1947, s. 128. DOI 10.1038/160128a0. Bibcode 1947Natur.160..128B.
- ↑ H. S. Kaufman; I. Fankuchen; H. Mark. Structure of Cyclo-octatetraene. Nature. 1948, s. 165. DOI 10.1038/161165a0. Bibcode 1948Natur.161..165K.
- ↑ P. M. Thomas; A. Weber. High resolution Raman spectroscopy of gases with laser sources. XIII – the pure rotational spectra of 1,3,5,7-cyclooctatetraene and 1,5-cyclooctadiene. Journal of Raman Spectroscopy. 1978, s. 353–357. DOI 10.1002/jrs.1250070614. Bibcode 1978JRSp....7..353T.
- ↑ K. H. Claus; C. Krüger. Structure of cyclooctatetraene at 129 K. Acta Crystallographica C. 1988-09-15, s. 1632–1634. DOI 10.1107/S0108270188005840.
- ↑ Tohru Nishinaga; Takeshi Ohmae; Masahiko Iyoda. Recent Studies on the Aromaticity and Antiaromaticity of Planar Cyclooctatetraene. Symmetry. 2010-02-05, s. 76–97. DOI 10.3390/sym2010076. Bibcode 2010Symm....2...76N.
- ↑ H. E. Zimmerman; G. L. Grunewald. The Chemistry of Barrelene. III. A Unique Photoisomerization to Semibullvalene. Journal of the American Chemical Society. 1966, s. 183–184. Dostupné online. DOI 10.1021/ja00953a045.
- ↑ C. Wang; J. Yuan; G. Li; Z. Wang; S. Zhang; Z. Xi. Metal-Mediated Efficient Synthesis, Structural Characterization, and Skeletal Rearrangement of Octasubstituted Semibullvalenes. Journal of the American Chemical Society. 2006, s. 4564–4565. DOI 10.1021/ja0579208. PMID 16594680.
- ↑ M. Stinson; D. Ezra; W. M. Hess; J. Sears; G. Strobel. An endophytic Gliocladium sp. of Eucryphia cordifolia producing selective volatile antimicrobial compounds. Plant Science. 2003, s. 913–922. DOI 10.1016/S0168-9452(03)00299-1.
- ↑ Eric J. Moorhead; Anna G. Wenzel. Two Undergraduate Experiments in Organic Polymers: The Preparation of Polyacetylene and Telechelic Polyacetylene via Ring-Opening Metathesis Polymerization. Journal of Chemical Education. 2009, s. 973. DOI 10.1021/ed086p973. Bibcode 2009JChEd..86..973M.
- ↑ Sango Kunichika. Cyclopolyolefins Derived from Acetylene. Bulletin of the Institute for Chemical Research, Kyoto University. 1953, s. 323–325.
- ↑ J. M. Holovka; P. D. Gardner; C. B. Strow; M. L. Hill; T. V. Van Auken. Photolysis and photoisomerization of cyclooctatetraene oxide. Journal of the American Chemical Society. 1968, s. 5041–5043. DOI 10.1021/ja01020a058.
- ↑ Thomas J. Katz. The cyclooctatetraenyl dianion. Journal of the American Chemical Society. 1960, s. 3784–3785. DOI 10.1021/ja01499a077.
- ↑ JST Nanostructed Materials Project Highlights – Prof. Nakajima's Presentation. www.nanostruct-mater.jst.go.jp [online]. [cit. 2022-01-15]. Dostupné v archivu pořízeném z originálu dne 2008-02-19.
- ↑ F. Albert Cotton; Douglas L. Hunter. Carbon-13 Nuclear Magnetic Resonance Study of the Fluxional Behavior of Cyclooctatetraenetricarbonyliron and -Ruthenium. Journal of the American Chemical Society. 1976, s. 1413–1417. DOI 10.1021/ja00422a022.
- ↑ R. Pettit; J. Henery. cis-dichlorocyclobutene. Organic Syntheses. 1970, s. 36. DOI 10.15227/orgsyn.050.0036.
- ↑ CYCLOBUTADIENE IN SYNTHESIS: Endo-TRICYCLO[4.4.0.02,5]DECA-3,8-DIENE-7,10-DIONE. Organic Syntheses. 1976, s. 43. DOI 10.15227/orgsyn.055.0043.
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
Model molekuly uranocenu
(c) V8rik from en.wikipedia.org, CC BY-SA 3.0
Cyclobutadieneiron tricarbonyl Synthesis
(c) V8rik from en.wikipedia.org, CC BY-SA 3.0
NewSemibullvaleneSynthesis
Structure of cyclooctatetraene
Cyclooctatetraenide.
three dimensional skeletal formula of (all)-Z-cyclooctatetraene (COT)