Derivát (chemie)
Derivát (chemický derivát, odvozená sloučenina, z latinského dērīvō - odvodit) je v chemii označení pro sloučeninu, která je vytvořena, nebo by teoreticky mohla být vytvořena, z mateřské nebo základní sloučeniny náhradou jednoho atomu jiným atomem nebo skupinou atomů.[1] Chemické reakce pro výrobu derivátů se nazývají derivatizace.
Termín derivát je běžný především v organické chemii a v biochemii. Je to proto, že právě organické sloučeniny jsou složené ze strukturních jednotek a funkčních skupin, které spolu vzájemně reagují a nahrazují se. Podmínkou je, aby funkční skupiny byly ve stejném oxidačním stavu. V biochemii se tento termín používá pro sloučeniny, které lze teoreticky nebo prakticky vytvořit z prekurzoru.[2]
Mateřská sloučenina a její deriváty jsou si strukturálně velmi podobné, ale mají odlišné vlastnosti. Namísto funkční skupiny mateřské sloučeniny se v derivátu nachází nová funkční skupina, která způsobuje, že deriváty mají obvykle výrazně odlišné chemické a fyzikální vlastnosti než mateřské sloučeniny.
Uhlík
Základní stavební kámen všech organických sloučenin a tím i všech živých organismů na této planetě je uhlík a jeho deriváty. Každá buňka živého organismu obsahuje desetitisíce chemických sloučenin, které mají tu jedinou společnou vlastnost, že jejich základní skelet je tvořen atomy uhlíku v různých vazebných stavech.
Schopnost uhlíku vytvářet řetězce a deriváty je tak obrovská, že v současné době bylo popsáno přibližně 10 milionů organických sloučenin. Jejich výčet je pravidelně registrován v Beilsteinově databázi, která shromažďuje souhrnná data o všech známých organických sloučeninách.
Organické sloučeniny obsahují alespoň jeden atom uhlíku a téměř vždy atomy vodíku. Každý atom uhlíku je schopen vytvářet celkem čtyři jednoduché vazby C-C, kromě toho i vazbu dvojnou C=C a vazbu trojnou C≡C. Mohou proto vznikat dlouhé řetězce a molekuly s rozvětvenou nebo cyklickou strukturou. Společně s uhlíkem se v těchto molekulách vážou i další prvky, především biogenní prvky vodík, kyslík, dusík, síra a fosfor, ale mohou to být i halogeny, křemík a mnoho dalších. Díky tomu existuje nesmírně mnoho kombinací.
Deriváty uhlovodíků
Z mateřské sloučeniny uhlovodíku náhradou atomu vodíku jiným atomem nebo funkční skupinou vznikají odvozené deriváty. Příklady derivátů ethanu:
- Ethan
- Ethanol
- Ethanal
- Kyselina ethanová
- Chlorethan
V následující tabulce najdeme rozdělení derivátů uhlovodíků podle atomů nebo skupin, které vodík nahradily. Halogenové deriváty jsou stejného typu, ale dusíkaté a kyslíkové deriváty se dále dělí podle toho, jaká dusíkatá nebo kyslíková skupina vodík nahradila.
| Halogenové deriváty -F, -Cl, -Br, -I | ||
|---|---|---|
| Dusíkaté deriváty -NH2, -NO2 | Aminoderiváty -NH2 | |
| Nitroderiváty -NO2 | ||
| Kyslíkaté deriváty | Hydroderiváty -OH | Alkoholy -OH na uhlovodíkovém řetězci |
| Fenoly -OH na benzenovém jádře | ||
| Deriváty etherů -O- | ||
| Karbonylové deriváty -CHO, -CO- | Aldehydy -CHO | |
| Ketony -CO- | ||
| Karboxylové deriváty -COOH |
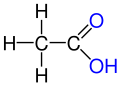
Deriváty kyseliny karboxylové
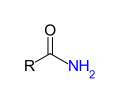
V předchozí tabulce jsme viděli rozdělení kyslíkatých derivátů na podskupiny hydroderivátů, derivátů etherů, karbonylových derivátů a karboxylových derivátů. Ty se od základní mateřské sloučeniny kyseliny karboxylové liší tím, že skupina -OH z funkční skupiny -COOH je nahrazena jiným atomem nebo skupinou. Příklady karboxylových derivátů:
- Kyselina karboxylová
- Halogenid kyseliny karboxylové
- Anhydrid karboxylové kyseliny
- Ester kyseliny karboxylové
- Amid kyseliny karboxylové
Derivatizace
Deriváty mohou být vyráběny pro specifické účely z mateřských sloučenin pomocí derivatizačních reakcí. Deriváty se často vyrábějí, aby splňovaly určité požadavky, které mateřská látka nesplňuje. Používají se v následujících oblastech:
- Farmacie: Deriváty by měly mít lepší snášenlivost nebo účinnost než základní látka.
- Oddělování: Deriváty by měly mít lepší nebo horší rozpustnost, aby je bylo možné oddělit od jiných látek filtrací nebo odstředěním.
- Syntéza: Deriváty by měly mít vyšší reaktivitu než mateřské sloučeniny, takže u těchto takzvaných reaktivních derivátů je snazší vytvořit nové vazby a syntetizovat nové látky.
- Analýza a separace: Deriváty by měly mít vyšší těkavost než základní látky, aby je bylo možné analyticky oddělit a identifikovat, například pomocí plynové chromatografie. Deriváty by měly být zbarveny tak, aby je bylo možné rozpoznat v tenkovrstvé chromatografii.
- Identifikace: Deriváty by měly být pevné a měly by mít definované body tání, aby bylo možné jasně identifikovat přidružené kořenové sloučeniny. Například při identifikaci mnoha organických sloučenin lze využít analýzu bodu tání. Lze připravovat krystalické deriváty, například semikarbazon nebo 2,4-dinitrofenylhydrazon (odvozením od aldehydů/ketonů), jakožto snadný způsob ověření totožnosti původní sloučeniny, za předpokladu, že je k dispozici tabulka bodů tání derivátů[3]. Před nástupem spektroskopické analýzy se tyto metody široce používaly.
Reference
V tomto článku byly použity překlady textů z článků Derivative (chemistry) na anglické Wikipedii a Derivat (chemie) na německé Wikipedii.
- ↑ Definition of Derivative [online]. Chemicool, 2007-09-18 [cit. 2007-09-18]. Dostupné online.
- ↑ Oxford Dictionary of Biochemistry and Molecular Biology. [s.l.]: Oxford University Press Dostupné online. ISBN 0-19-850673-2.
- ↑ WILLIAMSON, Kenneth L. Macroscale and Microscale Organic Experiments, 3rd ed.. Boston: Houghton-Mifflin, 1999. Dostupné online. ISBN 0-395-90220-7. S. 426–7.
Související články
Média použitá na této stránce
Carboxylate Ester
Struktur Chlorethan
Struktur Ethanal
Struktur Ethanol
Carboxylic Anhydride
Autor: Kchm123, Licence: CC BY-SA 4.0
Allgemeine Strukturfoemel eines Carbonsäurehalogenids
Lewis structural formula of ethane
General structure of carboxylic acid
Struktur Essigsäure
Carboxylic Amide