Dessův–Martinův perjodinan
| Dessův–Martinův perjodinan | |
|---|---|
 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | 3-oxo-1λ5,2-benzojodoxol-1,1,1(3H)-triyltriacetát |
| Sumární vzorec | C13H13IO8 |
| Vzhled | bílá pevná látka |
| Identifikace | |
| Registrační číslo CAS | 87413-09-0 |
| PubChem | 15337 |
| SMILES | CC(=O)OI1(C2=CC=CC=C2C(=O)O1)(OC(=O)C)OC(=O)C |
| InChI | InChI=1S/C13H13IO8/c1-8(15)19-14(20-9(2)16,21-10(3)17)12-7-5-4-6-11(12)13(18)22-14/h4-7H,1-3H3 |
| Vlastnosti | |
| Molární hmotnost | 424,14 g/mol |
| Hustota | 1,362 g/cm3 |
| Bezpečnost | |
| [1] | |
| H-věty | H272 H302 H312 H315 H319 H332 H335[1] |
| P-věty | P210 P220 P261 P264 P270 P271 P302+352 P304+340 P305+351+338 P321 P330 P370+378 P403+233 P405 P501[1] |
Některá data mohou pocházet z datové položky. | |
Dessův–Martinův perjodinan (zkráceně DMP) je organická sloučenina používaná při Dessových–Martinových oxidacích, oxidacích primárních alkoholů na aldehydy a sekundárních na ketony.[2][3]
Tato látka má několik výhod oproti dimethylsulfoxidu a oxidačních činidlech založených na chromu, jako jsou mírnější podmínky reakcí (pokojová teplota, neutrální pH), kratší časy reakcí, vyšší výtěžnosti, jednodušší postup, vysoká chemoselektivita, využitelnost i citlivých funkčních skupin a dlouhá životnost. Jejímu využití v průmyslu ovšem brání vysoká cena a potenciální výbušnost.[4]
DMP objevili v roce 1983 američtí chemici Daniel Benjamin Dess a James Cullen Martin. Odvozena je od kyseliny 2-jodoxybenzoové (IBX), na níž jsou navázány tři acetátové skupiny, jež navyšují reaktivitu a zlepšují rozpustnost sloučeniny v organických rozpouštědlech.[5]
Příprava
Nejprve se připraví IBX reakcí kyseliny 2-jodbenzoové s vodným roztokem hydrogenperoxosíranu draselného za zvýšené teploty po dobu 3 hodin.[6] Poté se IBX acyluje.[7]
Navázání acetylových skupin vede k vyšším výtěžkům a zjednodušuje provedení reakcí. Pevné produkty se získají filtrací a promytím diethyletherem. R. E. Ireland a L. Liu použili katalytické množství kyseliny p-toluensulfonové, čímž dosáhli dokončení reakce za méně než 2 hodiny (původní syntéza trvala 24 hodin), s výtěžnostmi nad 90 %.
Jiný postup představili R. K. Boeckman a J. J. Mullins,[8] šlo o zahřívání roztoku bromičnanu draselného, kyseliny sírové a kyseliny 2-jodbenzoové za vzniku kyseliny 2-jodoxybenzoové, která byla následně acylovaná kyselinou octovou a acetanhydridem.
Mechanismus oxidace
Dessův–Martinův perjodinan se používá hlavně jako oxidační činidlo pro alkoholy se složitou strukturou, obsahující více různých substituentů nebo citlivé skupiny. Jedním z důvodů jeho vysoké účinnosti je selektivní komplexace s hydroxylovými skupinami, která u alkoholů umožňuje rychlou výměnu ligandů, což je první krok oxidace.
Protonovou NMR bylo zjištěno, že jeden ekvivalent alkoholu vytvoří diacetoxyalkoxyperjodinanový meziprodukt. Následně octanový anion, sloužící jako zásada, deprotonuje α-vodík alkoholu za vzniku karbonylové sloučeniny, jodinanu a kyseliny octové.
Při použití diolu nebo více ekvivalentů jednosytného alkoholu vznikne acetoxydialkoxyperjodinan. V důsledku nestálosti tohoto perjodinanu je oxidace mnohem rychlejší.[5]
S. L. Schreiber se svými spolupracovníky zjistil, že rychlost oxidace je vyšší za přítomnosti vody.[9] Dess a Martin již předtím objevili, že se oxidace ethanolu urychlí přidáním dalšího ekvivalentu ethanolu. Předpokládá se, že navýšení míry disociace acetátového ligandu od jodu se zvyšuje z důvodu dodávání elektronů na hydroxyl, což oslabuje vazbu I-OAc.[5]
Chemoselektivita
Za podmínek standardních pro reakce Dessova–Martinova perjodinanu lze oxidovat alkoholy na aldehydy či ketony, aniž by byly ovlivněny furanové kruhy, thioethery, enolethery a sekundární amidy.[5] DMP snadno oxiduje allylalkoholy, které se běžnými oxidačními činidly na karbonylové sloučeniny převádějí obtížně.[10]
A. G. Myers přišel na to, že DMP může oxidovat aminoalkoholy chráněné na atomech dusíku, a to bez epimerizace (ke které dochází s většinou jiných oxidantů, například při Swernově oxidaci). Tyto chráněné aminoalkoholy mají význam ve farmaceutickém průmyslu.[11]
Benzyl- a allylalkoholy reagují rychleji než nasycené alkoholy,[5] zatímco aldoximy a ketoximy se na odpovídající aldehydy a ketony oxidují rychleji než primární, sekundární a benzylové alkoholy.[12]
Jako příklad Dessovy–Martinovy oxidace mohou sloužit přeměny citlivých α-β-nenasycených alkoholů na příslušné aldehydy. Takovéto skupiny se nacházejí v několika přírodních látkách a jsou užitečnými stavebními prvky v organické syntéze. C. Thongsornkleeb a Rick L. Danheiser zoxidovali takovýto alkohol pomocí Dessova–Martinova perjodinanu a pozměněným postupem (ředění pentanem a promytí poly(4-vinylpyridinem)) odstranili v průběhu reakce vytvořwnou kyselinu octovou; produkt byl pak zfiltrován a zkoncentrován destilací.[13]

t-Butyl DMP
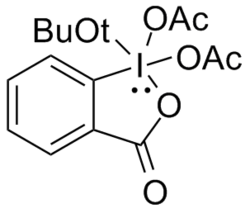
Difluor- a monofluoralkoholy se oxidují obtížněji. Lze u nich použít Swernovu oxidaci, kdy je ale nutný velký přebytek oxidačního činidla a v některých případech výsledky nejsou reprodukovatelné. Ve většině těchto případů může být použit DMP,[14] což ovšem neplatí u alkoholů obsahujících nukleofilní funkční skupiny, které z DMP odštěpují acetátové skupiny. S níže znázorněnou sloučeninou je možné získat takové karbonyly navázáním terc-butoxy skupin na DMP, jež vytvoří sterické efekty, skrz které se tyto vedlejší reakce omezí.
Odkazy
Související články
- Oxidace alkoholů
- Chlorchroman pyridinia
- Jonesova oxidace
- Oppenauerova oxidace
- Pfitznerova–Moffattova oxidace
- Parikhova–Doeringova oxidace
- Albrightova–Goldmanova oxidace
- Swernova oxidace
- Coreyova–Kimova oxidace
- Ruthenistan tetrapropylamonný
- TEMPO
Externí odkazy
 Obrázky, zvuky či videa k tématu Dessův–Martinův perjodinan na Wikimedia Commons
Obrázky, zvuky či videa k tématu Dessův–Martinův perjodinan na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku Dess–Martin periodinane na anglické Wikipedii.
- ↑ a b c https://pubchem.ncbi.nlm.nih.gov/compound/159087
- ↑ D. B. Dess; J. C. Martin. Readily accessible 12-I-5 oxidant for the conversion of primary and secondary alcohols to aldehydes and ketones. The Journal of Organic Chemistry. 1983, s. 4155–4156. doi:10.1021/jo00170a070.
- ↑ Robert J. Boeckman; Kelly M. George. Encyclopedia of Reagents for Organic Synthesis. [s.l.]: [s.n.], 2009. ISBN 978-0471936237. doi:10.1002/047084289X.rt157m.pub2. Kapitola 1,1,1-Triacetoxy-1,1-dihydro-1,2-benziodoxol-3(1H)-one.
- ↑ J. B. Plumb; D. J. Harper. Chemical Safety: 2-Iodoxybenzoic acid. Chemical & Engineering News. 1990, s. 3. doi:10.1021/cen-v068n029.p002.
- ↑ a b c d e D. B. Dess; J. C. Martin. A useful 12-I-5 triacetoxyperiodinane (the Dess-Martin periodinane) for the selective oxidation of primary or secondary alcohols and a variety of related 12-I-5 species. Journal of the American Chemical Society. 1991, s. 7277–7287. doi:10.1021/ja00019a027.
- ↑ M. Frigerio; M. Santagostino; S. Sputore. A User-Friendly Entry to 2-Iodoxybenzoic Acid (IBX). The Journal of Organic Chemistry. 1999, s. 4537–4538. doi:10.1021/jo9824596.
- ↑ R. E. Ireland; L. Liu. An improved procedure for the preparation of the Dess-Martin periodinane. The Journal of Organic Chemistry. 1993, s. 2899. doi:10.1021/jo00062a040.
- ↑ BOECKMAN JR., R. K.; SHAO, P.; MULLINS, J. J. The Dess-Martin Periodinane | 1,1,1-Triacetoxy-1,1-dihydro-1,2-benziodoxol-3(1H)-one. Org. Synth.. 2004. Dostupné online.; Coll. Vol.. S. 696.
- ↑ S. D. Meyer; S. L. Schreiber. Acceleration of the Dess-Martin Oxidation by Water. The Journal of Organic Chemistry. 1994, s. 7549–7552. doi:10.1021/jo00103a067.
- ↑ N. J. Lawrence; J. P. Crump; A. T. McGown; J. A. Hadfield. Reaction of Baylis-Hillman products with Swern and Dess-Martin oxidants. Tetrahedron Letters. 2001, s. 3939–3941. doi:10.1016/S0040-4039(01)00587-1.
- ↑ A. G. Myers et al. Synthesis of highly epimerizable N-protected amino aldehydes of high enantiomeric excess. Tetrahedron Letters. 2000, s. 1359. doi:10.1016/S0040-4039(99)02293-5.
- ↑ S. S. Chaudhari; K. G. Akamanchi. A mild, chemoselective, oxidative method for deoximation using Dess-Martin periodinane. Synthesis. 1999, s. 760–764. doi:10.1055/s-1999-3476.
- ↑ C. Thongsornkleeb; R. L. Danheiser. A Practical Method for the Synthesis of 2-Alkynylpropenals. The Journal of Organic Chemistry. 2005, s. 2364–2367. doi:10.1021/jo047869a. PMID 15760233.
- ↑ R. J. Linderman; D. M. Graves. Oxidation of Fluoroalkyl-Substituted Carbinols by the Dess-Martin reagent. The Journal of Organic Chemistry. 1989, s. 661–668. doi:10.1021/jo00264a029.
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Ball-and-stick model of the Dess–Martin periodinane molecule, C13H13IO8, as calculated using DFT.
Colour code:
- Carbon, C: grey-black
- Hydrogen, H: white
- Iodine, I: purple
- Oxygen, O: red
Structure calculated with DFT using the PBE0 functional with the LANL2DZ basis set extended with polarization (d) and diffuse (p) functions. Reported in J. Org. Chem. (2009) 74, 8818–8821.
Image generated in Accelrys DS Visualizer.Autor: Scmdorn, Licence: CC0
Reaction Scheme of Dess-Martin periodinane Oxidation
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for oxidizing substances
Autor: Rumsbums, Licence: CC BY-SA 3.0
This file shows the mechanism of oxidation of alcohols by DMP, deprotonation by acetate has been corrected.
Synthesis of the Dess-Martin periodinane
Autor: Mllyprry, Licence: CC BY-SA 4.0
Dess-Martin Oxidation of α-β-unsaturated alcohol to its corresponding aldehyde

















