Diamantoidy
Diamantoidy (též kondenzované adamantany) jsou molekuly se strukturou podobnou uhlovodíku adamantanu (C10H16), podobající se základní buňce krystalové mřížky diamantu. Diamantoidy mohou obsahovat ve svých molekulách jednu nebo více klecí (adamantan, diamantan, triamantan, a vyšší polymantany) i řadu jejich izomerních a strukturních obměn. Diamontoidy se vyskytují v ropě ha lze je izolovat jako čisté krystaly, které mohou obsahovat i dvanáct adamantanových jednotek na molekulu.[1]
Cyklohexamantan lze považovat za nanodiamant o hmotnosti přibližně 5,6×10−22 g.[2]
Příklady a reakce
- Adamantan (C10H16)
- Icean (C12H18)
- BC-8 (C14H20)
- Diamantan (C14H20), též nazývaný diadamantan, dvě klece spojené stěnami
- Triamantan (C18H24), též triadamantan. C4H4 jednotka napojená na jednu ze čtyř stěn diadamantanu.
- Isotetramantan (C22H28). C4H4 jednotka se může navázat na jednu z osmi stěn triamantanu, čímž mohou vzniknou čtyři různé izomery; jeden z nich je prochirální. Jednotlivé P a M-enantiomery lze od sebe oddělit.
- Pentamantan má devět izomerů se vzorcem C26H32; existuje také jiný pentamantan odpovídající vzorci C25H30.
- Cyklohexamantan (C26H30)
- Superadamantan (C30H36)
Jeden z izomerů tetramantanu je největším známým diamantoidem připraveným organickou syntézou z ketokarbenoidu.[3]
Větší diamantanoidy lze získat z kyseliny diamantandikarboxylové.[4]
První izolace diamantoidů z ropy byla provedena těmito kroky:[1] vakuovou destilací za teploty 345 °C (odpovídající teplotě varu), pyrolýzou při 400 až 450 °C (za účelem odstranění všech sloučenin mimo diamantoidy, které jsou tepelně mnohem stálejší) a posloupností separací pomocí vysokoúčinné kapalinové chromatografie.
V jedné studii se podařilo vytvořit derivát tetramantanu obsahující thiolové skupiny,[5] což umožnilo jejich zachycení na zlato a tvorbu monovrstev (diamantoidů na zlatu).
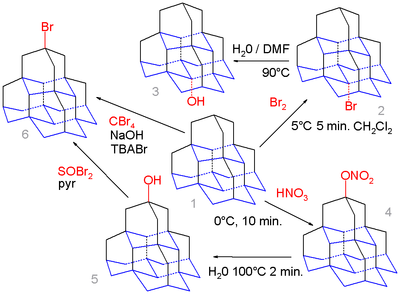
Prozkoumán byl také pentamantan.[6] Mediální izomer [1(2,3)4]pentamantanu (dole) by měl vytvářet energeticky výhodnější karbokation než apikální (nahoře) a jednoduchá bromace pentamantanu 1 elementárním bromem vytvářet pouze mediálně bromovaný derivát 2, který se po hydrolýze ve směsi vody a dimethylformamidu mění na alkohol 3.
Nitrooxylací sloučeniny 1 kyselinou dusičnou vzniká apikální nitrát 4, který see hydrolyzuje na apikální alkohol 5; aktivní elektrofilní činidlo NO -
2 HNO +
3 totiž vytváří silnější sterické efekty. Tento alkohol může dále reagovat s bromidem thionylu na bromid 6 a v několika krocích (které nejsou znázorněny) vytvořit thiol. Pentamantan také radikálově reaguje s tetrabrommethanem a tetra-n-butylamoniumbromidem (TBABr) za vzniku bromidu, tato reakce ale není selektivní.
Výskyt
Diamantoidy se nacházejí ve vysokovroucích ropných frakcích. Obsažený uhlík je biologického původu, což bylo potvrzeno srovnáním poměru přítomných izotopů uhlíku.[7]
Optické a elektronové vlastnosti
Diamantoidy absorbují v hluboké ultrafialové oblasti na energiích okolo 6 elektronvoltů a vyšších.[8]
Vzhled spektra jednotlivého diamantoidu závisí na velikosti, tvaru a symetrii jeho molekuly. Díky dobře určené velikosti a struktuře se diamantoidy používají jako modely pro výpočty elektronových struktur.[9]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Diamondoid na anglické Wikipedii.
- ↑ a b J. E. Dahl; S. G. Liu; R. M. K. Carlson. Isolation and Structure of Higher Diamondoids, Nanometer-Sized Diamond Molecules. Science. 2003-01-03, s. 96–99. doi:10.1126/science.1078239. PMID 12459548.
- ↑ J. E. P. Dahl, J. N. Moldowan, T. M. Peakman, J. C. Clardy, E. Lobkovsky, M. M. Olmstead, P. W. May, T. J. Davis, J. W. Steeds, K. E. Peters, A. Pepper, A. Ekuan, R. M. K. Carlson. Isolation and Structural Proof of the Large Diamond Molecule, Cyclohexamantane (C26H30). Angewandte Chemie International Edition. 2003, s. 2040–2044. doi:10.1002/anie.200250794. PMID 12746817.
- ↑ W. Burns; M. A. McKervey; T. R. Mitchell; J. J. Rooney. A New Approach to the Construction of Diamondoid Hydrocarbons. Synthesis of anti-Tetramantane. Journal of the American Chemical Society. 1978, s. 906–911. doi:10.1021/ja00471a041.
- ↑ J. Zhang, Z. Zhu, Y. Feng, H. Ishiwata, Y. Miyata, R. Kitaura, J. E. Dahl, R. M. Carlson, N. A. Fokina, P. R. Schreiner, D. Tománek, H. Shinohara. Evidence of diamond nanowires formed inside carbon nanotubes from diamantane dicarboxylic acid. Angewandte Chemie International Edition. 2013-03-25, s. 3717–3721. doi:10.1002/anie.201209192. PMID 23418054.
- ↑ Boryslav A. Tkachenko, Natalie A. Fokina, Lesya V. Chernish, Jeremy E. P. Dahl, Shenggao Liu, Robert M. K. Carlson, Andrey A. Fokin, Peter R. Schreiner. Functionalized Nanodiamonds Part 3: Thiolation of Tertiary/Bridgehead Alcohols. Organic Letters. 2006, s. 1767–1770. doi:10.1021/ol053136g. PMID 16623546.
- ↑ Andrey A. Fokin, Peter R. Schreiner, Natalie A. Fokina, Boryslav A. Tkachenko, Heike Hausmann, Michael Serafin, Jeremy E. P. Dahl, Shenggao Liu, Robert M. K. Carlson. Reactivity of [1(2,3)4]Pentamantane (Td-Pentamantane): A Nanoscale Model of Diamond. The Journal of Organic Chemistry. 2006, s. 8532–8540. doi:10.1021/jo061561x. PMID 17064030.
- ↑ M. R. Mello; J. M. Moldowan. Petroleum: To Be Or Not To Be Abiogenic [online]. 2005. Dostupné online.
- ↑ L. Landt; K. Klünder; J. E. Dahl; R. M. K. Carlson; T. Möller; C. Bostedt. Optical Response of Diamond Nanocrystals as a Function of Particle Size, Shape, and Symmetry. Physical Review Letters. 2009, s. 047402. Dostupné online. doi:10.1103/PhysRevLett.103.047402. PMID 19659398. Bibcode 2009PhRvL.103d7402L.
- ↑ M. Vörös; A. Gali. Optical absorption of diamond nanocrystals from ab initio density-functional calculations. Physical Review B. 2009, s. 161411. doi:10.1103/PhysRevB.80.161411. Bibcode 2009PhRvB..80p1411V.
Související články
- Ostatní sloučeniny se strukturou podobnou diamantu: Nitrid boritý
Externí odkazy
 Obrázky, zvuky či videa k tématu diamantoid na Wikimedia Commons
Obrázky, zvuky či videa k tématu diamantoid na Wikimedia Commons