Dianhydrid kyseliny pyromellitové
| Dianhydrid kyseliny pyromellitové | |
|---|---|
 Strukturní vzorec | |
| Obecné | |
| Systematický název | 1H,3H-benzo[1,2-c:4,5-c′]difuran-1,3,5,7-tetron |
| Sumární vzorec | C10H2O6 |
| Vzhled | bílé krystaly[1] |
| Identifikace | |
| Registrační číslo CAS | 89-32-7 |
| EC-no (EINECS/ELINCS/NLP) | 201-898-9 |
| PubChem | 6966 |
| SMILES | C1=C2C(=CC3=C1C(=O)OC3=O)C(=O)OC2=O |
| InChI | 1S/C10H2O6/c11-7-3-1-4-6(10(14)16-8(4)12)2-5(3)9(13)15-7/h1-2H |
| Vlastnosti | |
| Molární hmotnost | 218,12 g/mol |
| Teplota tání | 286 °C (559 K)[1] |
| Teplota varu | 397 až 400 °C (670 až 673 K)[1] |
| Hustota | 1,68 g/cm3[1] |
| Rozpustnost ve vodě | reaguje[1] |
| Tlak páry | 0,64 mPa[1] |
| Bezpečnost | |
| [1] | |
| H-věty | H317 H318 H334[1] |
| P-věty | P261 P264+265 P272 P280 P284 P302+352 P304+340 P305+354+338 P317 P332 P333+313 P342+316 P362+364 P501[1] |
Některá data mohou pocházet z datové položky. | |
Dianhydrid kyseliny pyromellitové je organická sloučenina se vzorcem C6H2(C2O3)2, dvojnásobný anhydrid odvozený od kyseliny mellitové, používaný při výrobě polyimidů. Jedná se o bíle zbarvenou, hygroskopickou, pevnou látku, která tvoří hydrát.
Příprava a výroba
Dianhydrid kyseliny pyromellitové se vyrábí oxidací plynného 1,2,4,5-tetramethylbenzenu (nebo některého podobného tetrasubstituovaného benzenu):[2]
- C6H2(CH3)4 + 6 O2 → C6H2(C2O3)2 + 6 H2O
V laboratoři se dá získat dehydratací kyseliny pyromellitové pomocí acetanhydridu.[3]
Reakce
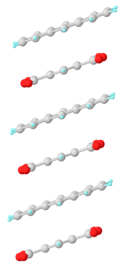
Dianhydrid kyseliny pyromellitové se může, jako akceptor elektronů, zapojit do tvorby komplexů. Reakcemi s aminy vytváří diimidy, C6H2[(CO)2NR]2, které mají také akceptorní vlastnosti.[5]
Použití
Tato látka se používá při recyklování PET lahví jako činidlo prodlužující řetězec. Molekulovou hmotnost polymeru zvyšuje propojováním hydroxylových a karboxylových skupin; tím se dosahuje lepších reologických a dalších vlastností recyklovaného plastu.[6]
Bezpečnost
Vystavení tomuto anhydridu může způsobit astma.[7]
Odkazy
Externí odkazy
 Obrázky, zvuky či videa k tématu Dianhydrid kyseliny pyromellitové na Wikimedia Commons
Obrázky, zvuky či videa k tématu Dianhydrid kyseliny pyromellitové na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku Pyromellitic dianhydride na anglické Wikipedii.
- ↑ a b c d e f g h i https://pubchem.ncbi.nlm.nih.gov/compound/696
- ↑ RÖHRSCHEID, Freimund. Carboxylic Acids, Aromatic. Příprava vydání Wiley-VCH Verlag GmbH & Co. KGaA. Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA Dostupné online. ISBN 978-3-527-30673-2. DOI 10.1002/14356007.a05_249. S. a05_249. (anglicky) DOI: 10.1002/14356007.a05_249.
- ↑ E. Philippi; R. Thelen. Pyromellitic Acid. Organic Syntheses. 1930, s. 90. DOI 10.15227/orgsyn.010.0090.
- ↑ B. E. Robertson; J. J. Stezowski. The crystal structure of the π-molecular complex of anthracene with pyromellitic dianhydride at –120 °C. Acta Crystallographica Section B. 1978, s. 3005–3011. DOI 10.1107/S0567740878009929.
- ↑ Zhiping Song; Hui Zhan; Yunhong Zhou. Polyimides: Promising Energy-Storage Materials. Angewandte Chemie International Edition. 2010, s. 8444–8448. DOI 10.1002/anie.201002439. PMID 20862664.
- ↑ L. Incarnato; P. Scarfato; L. Di Maio; D. Acierno. Structure and rheology of recycled PET modified by reactive extrusion. Polymer. 2000, s. 6825–6831. DOI 10.1016/S0032-3861(00)00032-X.
- ↑ Milene Torp Madsen; Lars Rauff Skadhauge; Anders Daldorph Nielsen; Jesper Baelum; David Lee Sherson. Pyromellitic dianhydride (PMDA) may cause occupational asthma. Occupational and Environmental Medicine. 2019, s. 175–177. DOI 10.1136/oemed-2018-105295. PMID 30635433.
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Chemical structure of pyromellitic dianhydride
Autor: Smokefoot, Licence: CC BY-SA 4.0
structure of the complex formed upon co-crystallization of pyromellitic anhydride and anthracene.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances





