Diethylzinek
| Diethylzinek | |
|---|---|
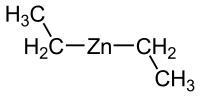 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | diethylzinek |
| Funkční vzorec | (C2H5)2Zn |
| Sumární vzorec | C4H10Zn |
| Vzhled | bezbarvá kapalina[1] |
| Identifikace | |
| Registrační číslo CAS | 557-20-0 |
| EC-no (EINECS/ELINCS/NLP) | 209-161-3 |
| PubChem | 11185 |
| SMILES | C[CH2-].C[CH2-].[Zn+2] |
| InChI | 1S/2C2H5.Zn/c2*1-2;/h2*1H2,2H3;/q2*-1;+2 |
| Vlastnosti | |
| Molární hmotnost | 123,53 g/mol |
| Teplota tání | −28 °C (245 K)[1] |
| Teplota varu | 118 °C (391 K)[1] |
| Hustota | 1,207 g/cm3 (20 °C)[1] |
| Rozpustnost ve vodě | nebezpěčně reaguje |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v petroletheru, benzenu a diethyletheru[1] |
| Tlak páry | 2,78 kPa[1] |
| Bezpečnost | |
| [1] | |
| H-věty | H225 H250 H260 H314 H318 H400 H410}[1] |
| P-věty | P210 P222 P223 P231+232 P233 P240 P241 P242 P243 P260 P264 P273 P280 P301+330+331 P302+334 P303+361+353 P304+340 P305+351+338 P310 P321 P335+334 P363 P370+378 P391 P402+404 P403+235 P405 P422 P501[1] |
Některá data mohou pocházet z datové položky. | |
Diethylzinek (zkráceně DEZ) je organická sloučenina se vzorcem (C2H5)2Zn, jedná se o vysoce samozápalnou organozinečnatou sloučeninu obsahující centrum tvořené atomem zinku, na nějž jsou navázány dvě ethylové skupiny. Používá se jako reaktant v organické chemii; dostupný je jak jako roztok v hexanu, heptanu či toluenu, tak i v čisté podobě jako bezbarvá kapalina.
Příprava a výroba
Edward Frankland popsal v roce 1848 přípravu této sloučeniny z kovového zinku a jodethanu, jednalo se o první známou organozinečnatou sloučeninu.[2][3] Přípravu poté vylepšil použitím diethylrtuti jako výchozího materiálu.[4] V současnosti se vyrábí reakcí směsi jodethanu a bromethanu v molárním poměru 1 : 1 za přítomnosti slitiny zinku a mědi jako zdroje reaktivního zinku.[5]
Struktura
Diethylzinek krystalizuje v tetragonální bazálně centrované elementární buňky s grupami symetrie typu I41md. V pevném skupenství jsou Zn centra téměř lineární. Délka vazeb Zn-C činí 194,8(5) pm, vazebné úhly C-Zn-C mají hodnoty 176,2(4)°.[6] Plynná fáze vykazuje obdobné vzdálenosti Zn-C (195,0(2) pm).[7]
Použití
I přesto, že se snadno samovznítí, tak je diethylzinek významným reaktantem. Používá se v organické syntéze jako zdroj ethylových karboaniontů při adicích na karbonylové skupiny a asymetrických adicích ethylových skupin na benzaldehyd[8] a iminy.[9] Navíc může sloužit společně s dijodmethanem jako složka Simmonsova–Smithova činidla k přeměně alkenů na cyklopropylové sloučeniny.[10][11] Je slabším nukleofilem než alkyllithná a Grignardova činidla, a používá se tak v případech, kdy je potřeba „mírnější“ nukleofil. Tato sloučenina má také široké využití v materiálové chemii jako zdroj zinku při přípravě nanočástic, například slouží k tvorbě vrstev sulfidu zinečnatého na kvantových tečkách.[12] V polymerní chemii jej lze použít jako část katalyzátoru pro živé polymerizace.[13]
Diethylzinek má i nechemická využití. Vzhledem k rychlé reakci se vzduchem byl používán jako krátkodobé samozápalné raketové palivo, které se při styku s oxidačním činidlem zapálí, takže k zapálení paliva nebyl potřebný zdroj jisker. Diethylzinek byl také zkoumán jako možný prostředek k odkyselování knih. Páry diethylzinku mohou neutralizovat pozůstatky kyselin v papíru, přičemž zanechávají mírně zásaditý oxid zinečnatý. Postup nakonec nebyl zaveden kvůli řadě nežádoucích projevů, například několika výbuchům při styku stopových množství diethylzinku s vodní parou.[14]
K protikorozní ochraně lehkovodních jaderných reaktorů se používá oxid zinečnatý ochuzený o 64Zn, vyráběný průchodem diethylzinku obohacovací odstředivkou.
Samozápalnost diethylzinku lze využít k otestování inertní atmosféry v rukavicovém boxu. Při i velmi nízkých koncentracích kyslíku začne otevřená láhev diethylzinku dýmat.[15]
Bezpečnost
Diethylzinek nebezpečně reaguje s vodou a na vzduchu je samozápalný, měl by tak být skladován v inertním prostředí.
Odkazy
Externí odkazy
 Obrázky, zvuky či videa k tématu Diethylzinek na Wikimedia Commons
Obrázky, zvuky či videa k tématu Diethylzinek na Wikimedia Commons - Ukázka samovznícení diethylzinku na vzduchu Video – University of Nottingham
Reference
V tomto článku byl použit překlad textu z článku Diethylzinc na anglické Wikipedii.
- ↑ a b c d e f g h i https://pubchem.ncbi.nlm.nih.gov/compound/11185
- ↑ E. Frankland. On the isolation of the organic radicals. Quarterly Journal of the Chemical Society. 1850, s. 263. Dostupné online. DOI 10.1039/QJ8500200263. (anglicky)
- ↑ Dietmar Seyferth. Zinc Alkyls, Edward Frankland, and the Beginnings of Main-Group Organometallic Chemistry. Organometallics. 2001, s. 2940–2955. DOI 10.1021/om010439f. (anglicky)
- ↑ E. Frankland, B. F. Duppa. On a new reaction for the production of the zinc-compounds of the alkyl-radical. Journal of the Chemical Society. 1864, s. 29–36. Dostupné online. DOI 10.1039/JS8641700029. (anglicky)
- ↑ C. R. NOLLER. Diethyl Zinc. Org. Synth.. 1943. Dostupné online. (anglicky); Coll. Vol.. S. 184. (anglicky)
- ↑ John Bacsa; FELIX HANKE; SARAH HINDLEY; RAJESH ODEDRA; GEORGE R. DARLING; ANTHONY C. JONES; ALEXANDER STEINER. The Solid State Structures of Dimethylzinc and Diethylzinc. Angewandte Chemie International Edition. 2011, s. 11685–11687. DOI 10.1002/anie.201105099. PMID 21919175. (anglicky)
- ↑ A. Haaland; J. C. GREEN; G. S. MCGRADY; A. J. DOWNS; E. GULLO; M. J. LYALL; J. TIMBERLAKE. The length, strength and polarity of metal–carbon bonds: dialkylzinc compounds studied by density functional theory calculations, gas electron diffraction and photoelectron spectroscopy. Dalton Transactions. 2003, s. 4356–4366. DOI 10.1039/B306840B. (anglicky)
- ↑ MASATO KITAMURA, HIROMASA OKA, SEIJI SUGA, AND RYŌJI NOYORI. Catalytic Enantioselective Addition of Dialkylzincs to Aldehydes Using (2S)-(−)-3-exo-(Dimethylamino)isoborneol [(2S)-DAIB]: (S)-1-Phenyl-1-propanol. Org. Synth.. 2004. Dostupné online. (anglicky); Coll. Vol.. S. 635. (anglicky)
- ↑ JEAN-NICOLAS DESROSIERS, ALEXANDRE CÔTÉ, ALESSANDRO A. BOEZIO, AND ANDRÉ B. CHARETTE. Preparation of Enantiomerically Enriched (1S)-1-Phenylpropan-1-amine Hydrochloride by a Catalytic Addition of Diorganozinc Reagents to Imines. Org. Synth.. 2005, s. 5. Dostupné online. (anglicky)
- ↑ ANDRÉ B. CHARETTE AND HÉLÈNE LEBEL. (2S,3S)-(+)-(3-Phenylcyclopropyl)methanol. Org. Synth.. 2004. Dostupné online. (anglicky); Coll. Vol.. S. 613. (anglicky)
- ↑ YOSHIHIKO ITO, SHOTARO FUJII, MASASHI NAKATUSKA, FUMIO KAWAMOTO, AND TAKEO SAEGUSA. One-Carbon Ring Expansion of Cycloalkanones to Conjugated Cycloalkenones: 2-Cyclohepten-1-one. Org. Synth.. 1988. Dostupné online. (anglicky); Coll. Vol.. S. 327. (anglicky)
- ↑ Dmitri V. Talapin; IVO MEKIS; STEPHAN GÖTZINGER; ANDREAS KORNOWSKI; OLIVER BENSON; HORST WELLER†. CdSe/CdS/ZnS and CdSe/ZnSe/ZnS Core−Shell−Shell Nanocrystals. Journal of Physical Chemistry B. 2004, s. 18826–18831. DOI 10.1021/jp046481g. (anglicky)
- ↑ Mitsuo Sawamoto; CHIHIRO OKAMOTO; TOSHINOBU HIGASHIMURA. Hydrogen iodide/zinc iodide: a new initiating system for living cationic polymerization of vinyl ethers at room temperature. Macromolecules. 1987, s. 2693–2697. DOI 10.1021/ma00177a010. (anglicky)
- ↑ Kenneth E. Harris; CHANDRU J. SHAHANI. Mass Deacidification: An Initiative To Refine The Diethyl Zinc Process. Washington, D.C.: Library of Congress, 2004. Dostupné v archivu pořízeném z originálu dne 2013-05-14. (anglicky)
- ↑ SHRIVER, Duward F.; DREZDZON, Mark A. The Manipulation of Air-Sensitive Compounds. [s.l.]: John Wiley & Sons, 1986. ISBN 0-471-86773-X. S. 57. (anglicky)
Média použitá na této stránce
Ball-and-stick model of the diethylzinc molecule, Zn(C2H5)2
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances







