Difenyldiselenid
| Difenyldiselenid | |
|---|---|
 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | difenyldiselenid |
| Ostatní názvy | 1,1′-diselandiyldibenzen |
| Funkční vzorec | C6H5-Se-Se-C6H5 |
| Sumární vzorec | C12H10Se2 |
| Vzhled | žluté krystaly |
| Identifikace | |
| Registrační číslo CAS | 1666-13-3 |
| EC-no (EINECS/ELINCS/NLP) | 216-780-2 |
| PubChem | 15460 |
| SMILES | c1ccc(cc1)[Se][Se]c2ccccc2 |
| InChI | InChI=1S/C12H10Se2/c1-3-7-11(8-4-1)13-14-12-9-5-2-6-10-12/h1-10H |
| Číslo RTECS | JM9152500 |
| Vlastnosti | |
| Molární hmotnost | 312,09 g/mol |
| Hustota | 1,84 g/cm3 |
| Rozpustnost ve vodě | nerozpustný |
| Rozpustnost v polárních rozpouštědlech | rozpustný v tetrahydrofuranu |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v dichlormethanu a hexanu |
| Bezpečnost | |
| H-věty | H301 H331 H373 H410 |
| P-věty | P260 P261 P264 P270 P271 P273 P301+310 P304+340 P311 P314 P321 P330 P391 P403+233 P405 P501 |
Některá data mohou pocházet z datové položky. | |
Difenyldiselenid je organická sloučenina se vzorcem (C6H5)2Se2, zkracovaným na Ph2Se2, jedná se o oxidovaný derivát benzenselenolu. Používá se v organické syntéze jako zdroj PhSe skupin.
Příprava a vlastnosti
Ph2Se2 se připravuje oxidací benzenselenoátu, konjugované zásady benzenselenolu, získávané z odpovídajícího Grignardova činidla:[1]
- PhMgBr + Se → PhSeMgBr
- 2 PhSeMgBr + Br2 → Ph2Se2 + 2 MgBr2
Molekula vykazuje C2-symetrii, podobně jako peroxid vodíku a jiné podobné molekuly. Délka vazby Se-Se činí 229 pm, dihedrální úhel C-Se-Se-C má velikost 82° a vazebný úhel C-Se-Se je přibližně 110°.[2]
Použití
Dfenyldiselenid zmírňuje následky otravy methylrtutí u amurů bílých.[3]
Reakce
Typickou reakcí Ph2Se2 je jeho redukce:
- Ph2Se2 + 2 Na → 2 PhSeNa
PhSeNa je nukleofil používaný na tvorbu fenylselenylových skupin nukleofilními substitucemi alkylhalogenidů, alkylsulfonátů (mesylátů nebo tosylátů) a epoxidů. Níže je uvedena reakce použitá při přípravě morfinu.[4]
Další reakcí je chlorace:
- Ph2Se2 + Cl2 → 2 PhSeCl
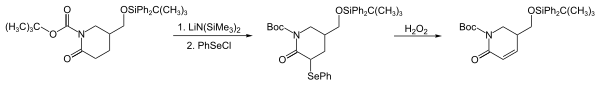
PhSeCl má elektrofilní vlastnosti a slouží k zavádění PhSe skupin reakcemi s nukleofily, jako jsou enoláty, silylenolethery, Grignardova činidla, organolithné sloučeniny, alkeny, a aminy. V níže zobrazené posloupnosti reakcí, tvořící ranou část syntézy strychnofolinu, se PhSe skupina tvoří reakcí laktamenolátu s PhSeCl;[5]
Tímto způsobem lze převádět karbonylové sloučeniny na jejich α,β-nenasycené analogy.[6]
Difenyldiselenid je také zdrojem slabě elektrofilní skupiny PhSe v reakcích se silnými nukleofily, jako jsou Grignardova činidla, organolithné sloučeniny a enoláty esterů (ale ne enoláty ketonů nebo slabšími nukleofily). PhSeCl je reaktivnější i účinnější, protože u Ph2Se2 se spotřebuje jen polovina selenu.
- Ph2Se2 + Nu− → PhSeNu + PhSe−
PhSeCl může být nahrazen N-fenylselenoftalimidem (N-PSP) tam, kde by sám byl příliš silný a difenyldiselenid příliš slabý.[7]
Reference
V tomto článku byl použit překlad textu z článku Diphenyl diselenide na anglické Wikipedii.
- ↑ REICH, H. J.; COHEN, M. L.; CLARK, P. S. Reagents for Synthesis of Organoselenium Compounds: Diphenyl Diselenide and Benzeneselenenyl Chloride. Org. Synth.. 1979, s. 141. Dostupné online.; Coll. Vol.. S. 533.
- ↑ R. E. Marsh. The Crystal Structure of Diphenyl Diselenide. Acta Crystallographica. 1952, s. 458–462. DOI 10.1107/S0365110X52001349.
- ↑ Matheus D. Baldissera; Carine F. Souza; Aleksandro S. da Silva; Alessandra S. Henn; Erico M. M. Flores; Bernardo Baldisserotto. Diphenyl diselenide dietary supplementation alleviates behavior impairment and brain damage in grass carp (Ctenopharyngodon idella) exposed to methylmercury chloride. Comparative Biochemistry and Physiology. Toxicology & Pharmacology. 2020, s. 108674. ISSN 1532-0456. DOI 10.1016/j.cbpc.2019.108674. PMID 31760078.
- ↑ D. F. Taber; T. D. Neubert; A. L. Rheingold. Synthesis of (−)-Morphine. Journal of the American Chemical Society. 2002, s. 12416–12417. DOI 10.1021/ja027882h. PMID 12381175.
- ↑ A. Lerchner; E. M. Carreira. First Total Synthesis of (±)-Strychnofoline via a Highly Selective Ring-Expansion Reaction. Journal of the American Chemical Society. 2002, s. 14826–14827. DOI 10.1021/ja027906k. PMID 12475306.
- ↑ H. J. Reich; S. Wollowitz. Preparation of α,β-Unsaturated Carbonyl Compounds and Nitriles by Selenoxide Elimination. Organic Reactions. 1993, s. 1–296. ISBN 0471264180. DOI 10.1002/0471264180.or044.01.
- ↑ A. F. Barrero; E. J. Alvarez-Manzaneda; R. Chahboun; M. Corttés; V. Armstrong. Synthesis and Antitumor Activity of Puupehedione and Related Compounds. Tetrahedron. 1999, s. 15181–15208. DOI 10.1016/S0040-4020(99)00992-8.
Externí odkazy
 Obrázky, zvuky či videa k tématu difenyldiselenid na Wikimedia Commons
Obrázky, zvuky či videa k tématu difenyldiselenid na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for toxic substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
Space-filling model of the diphenyl diselenide molecule, C12H10Se2, as found in the crystal structure.
Colour code:
- Carbon, C: grey
- Hydrogen, H: white
- Selenium, Se: orange
Structure determined by X-ray crystallography, reported in J. Am. Chem. Soc. (2010) 132, 5799–5802 (DPHDSE02).
Model manipulated and image generated in CCDC Mercury 3.0.Autor: Muskid, Licence: CC BY-SA 3.0
Early reaction steps in the synthesis of strychnofoline.
Diphenyldiselenide down C2
Autor: Muskid, Licence: CC BY-SA 3.0
Usage of sodium benzeneselenolate in the synthesis of morphine.