Diisopropylamid lithný
| Diisopropylamid lithný | |
|---|---|
 strukturní vzorec | |
| Obecné | |
| Systematický název | diisopropylamid lithný |
| Sumární vzorec | C6H14LiN |
| Vzhled | bezbarvá pevná látka |
| Identifikace | |
| Registrační číslo CAS | 4111-54-0 |
| PubChem | 2724682 |
| SMILES | [Li+].[N-](C(C)C)C(C)C |
| InChI | InChI=1S/C6H14N.Li/c1-5(2)7-6(3)4;/h5-6H,1-4H3;/q-1;+1 |
| Vlastnosti | |
| Molární hmotnost | 107,123 g/mol |
| Teplota tání | 161 °C (434 K) |
| Hustota | 0,79 g/cm3 |
| Disociační konstanta pKa | 36 (v THF) |
| Rozpustnost ve vodě | reaguje |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
Některá data mohou pocházet z datové položky. | |
Diisopropylamid lithný (anglicky lithium diisopropylamide, zkratka LDA) je organická sloučenina lithia se vzorcem [(CH3)2CH]2NLi. Používá se v organické syntéze jako silná zásada; jeho časté používání vyplývá z dobré rozpustnosti v nepolárních rozpouštědlech a z nenukleofilní povahy této látky. V čisté podobě jde o bezbarvou pevnou látku, ovšem často se připravuje a používá pouze jako roztok.
Příprava a struktura
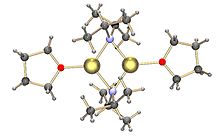
Diisopropylamid lithný se obvykle připravuje reakcí chladného (0 až −78 °C) roztoku diisopropylaminu v tetrahydrofuranu (THF) s N-butyllithiem.[2]
Při disociaci je diisopropylamid protonován za vzniku diisopropylaminu. Diisopropylamin má v THF pKa 36, jeho konjugovaná zásada může tedy deprotonovat kyselejší sloučeniny; řada těchto sloučenin patří mezi kyseliny s obecným vzorcem R2CHZ, kde Z = C(O)R', CO2R' nebo CN. Běžné protické funkční skupiny jako alkoholy a karboxylové kyseliny lze také snadno deprotonovat.
Podobně jako většina ostatních organolithných sloučenin není diisopropylamid lithný solí, ale přesto je značně polární. V roztocích vytváří shluky; míra shlukování závisí na vlastnostech použitého rozpouštědla. V THF se vyskytuje převážně jako solvatovaný dimer.[3][4] V nepolárních rozpouštědlech, k jakým patří mimo jiné toluen, tvoří oligomery, které jsou navzájem v rovnováze závislé na teplotě; při pokojové teplotě jsou v největších množstvích přítomny trimery a tetramery. Při snižování teploty dochází k tvorbě pentamerních i složitějších oligomerních struktur.[5]
V pevném skupenství je tato látka značně pyroforická,[6] ovšem v roztocích tuto vlastnost obvykle nemá. Je komerčně dostupná ve formě roztoků v polárních aprotických rozpouštědlech jako jsou THF a diethylether, ovšem pro použití v malých množstvích (do 50 mmol) je mnohem častější a méně nákladná příprava přímo v laboratoři.
Kinetické a termodynamické zásady
Deprotonace karbonových kyselin může být řízena kineticky i termodynamicky. Při kineticky řízené deprotonaci je třeba použít zásadu, která obsahuje stericky ovlivněné funkční skupiny; například při použití fenylacetonu při deprotonaci vzniknou dva různé enoláty. Ukázalo se, že když diisopropylamid lithný deprotonuje methylovou skupinu, tak se jedná o kineticky řízenou reakci. Slabší zásady jako jsou alkoxidy, které substrát deprotonují vratně, vytvářejí termodynamicky stabilnější benzylové enoláty. Alternativou k použití slabých zásadad je přítomnost silných zásad v nižších koncentracích, než má příslušný keton; například u směsi hydridu sodného s tetrahydrofuranem nebo dimethylformamidem (DMF) reaguje zásada pouze na rozhraní mezi roztokem a pevnou fází. Molekula ketonu může být deprotonována na kinetickém místě. Vzniklý enolát může reagovat s dalším ketonem a vytvořit tak výměnou protonů termodynamický enolát, a to i v aprotických rozpouštědlech, která neuvolňují hydroniové ionty.
Za určitých podmínek může diisopropylamid lithný fungovat jako nukleofil.
Odkazy
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu Diisopropylamid lithný na Wikimedia Commons
Obrázky, zvuky či videa k tématu Diisopropylamid lithný na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku Lithium diisopropylamide na anglické Wikipedii.
- ↑ a b Lithium diisopropylamide. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ SMITH, A. P.; LAMBA, J. J. S.; FRASER, C. L. Efficient Synthesis of Halomethyl-2,2'-Bipyridines: 4,4'-Bis(chloromethyl)-2,2'-Bipyridine. Org. Synth.. 2004. Dostupné online.; Coll. Vol.. S. 107.
- ↑ Williard, P. G.; SALVINO, J. M. Synthesis, isolation, and structure of an LDA-THF complex. Journal of Organic Chemistry. 1993, s. 1–3. DOI 10.1021/jo00053a001.
- ↑ N.D.R. Barnett; R.E. MULVEY; W. CLEGG; P.A. O'NEIL. Crystal structure of lithium diisopropylamide (LDA): an infinite helical arrangement composed of near-linear nitrogen-lithium-nitrogen units with four units per turn of helix. Journal of the American Chemical Society. 1991, s. 8187. DOI 10.1021/ja00021a066.
- ↑ Neufeld, R.; John, M., Stalke, D.; YES. The Donor-Base-Free Aggregation of Lithium Diisopropyl Amide in Hydrocarbons Revealed by a DOSY Method. Angewandte Chemie International Edition. 2015, s. 6994–6998. DOI 10.1002/anie.201502576.
- ↑ MSDS at Sigma-Aldrich
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Autor: en:User:Cadmium, Licence: CC BY-SA 3.0
Dimer of lithium diisopropyl amide in THF.
chemical structure of lithium diisopropylamide





