Diketen
| Diketen | |
|---|---|
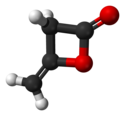
 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | 4-methylidenoxetan-2-on |
| Ostatní názvy | γ-methylenpropiolakton |
| Anglický název | Diketene |
| Německý název | Diketen |
| Sumární vzorec | C4H4O2 |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 674-82-8 |
| SMILES | O=C1OC(=C)C1 |
| InChI | 1S/C4H4O2/c1-3-2-4(5)6-3/h1-2H2 |
| Vlastnosti | |
| Molární hmotnost | 84,08 g/mol |
| Teplota tání | −7 °C (266 K) |
| Teplota varu | 127 °C (400 K) |
| Bezpečnost | |
| [1] Varování[1] | |
Některá data mohou pocházet z datové položky. | |
Diketen je organická sloučenina, derivát oxetanu. Vyrábí se dimerizací ketenu. Používá se jako reagent v organické chemii.
Výroba
Keten se vyrábí dehydratací kyseliny octové při 700–750 °C za přítomnosti triethylfosfátu jako katalyzátoru nebo termolýzou acetonu při 600–700 °C za katalýzy sirouhlíkem.[2]
- CH3CO2H H2C=C=O + H2O ΔH = +147 kJ mol−1
- CH3COCH3 H2C=C=O + CH4
Následná dimerizace na diketen probíhá spontánně při pokojové teplotě:
- 2 H2C=C=O C4H2O2
Reakce
Zahřátím nebo působením ultrafialového záření[3] vzniká monomer keten:
- (C2H2O)2 ⇌ 2 CH2CO
Alkylované keteny se také snadno dimerizují a tvoří substituované diketeny.
Diketen se snadno hydrolyzuje za vzniku kyseliny acetyloctové, poločas této reakce je při 25 °C a 2 < pH < 7 přibližně 45 minut.[4]
Některé diketeny s alifatickými řetězci se používají na úpravu hydrofobie papíru.
V minulosti se acetanhydrid připravoval reakcí diketenu s kyselinou octovou[2]
- H2C=C=O + CH3COOH → (CH3CO)2O ΔH = −63 kJ mol−1
Acetacetylace
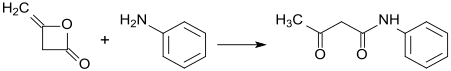
Diketen také reaguje s alkoholy a aminy za vzniku odpovídajících derivátů kyseliny acetyloctové, tato reakce se někdy nazývá acetacetylace. Příkladem může být reakce s 2-aminoindanem[5]
Diketen je důležitým průmyslovým neziproduktem při výrobě esterů a amidů kyseliny acetyloctové a také soubstituovaných 1-fenyl-3-methylpyrazolonů, které se používají na výrobu barviv.[6] Příkladem příslušné reakce je:
- ArNH2 + (CH2CO)2 → ArNHC(O)CH2C(O)CH3
Tyto acetacetamidy jsou prekurzory barviv jako je například arylidová žluť.
Použití
Diketeny s dvěma alkylovými skupinami se používají ve výrobě papíru na úpravu jeho tiskových vlastností (pomocí hydrofobizace). Asi 60 % takto používaných látek tvoří živičné pryskyřice a kolem 16 % diketeny s dlouhými řetězci nazývané alkylketenové dimery (AKD), které se obvykle používají v koncentraci 0,15 %, tedy 1,5 kg pevných AKD na tunu papíru.
Výroba AKD zahrnuje chloraci mastných kyselin s dlouhým řetězcem (například kyseliny stearové) za použití chloračních činidel jako je thionylchlorid, přičemž vznikají chloridy těchto kyselin, a následnou eliminaci HCl pomocí aminů (například triethylaminu) rozpuštěných v toluenu nebo jiných rozpouštědlech.:[7]
Diketeny jsou také meziprodukty výroby léčiv, insekticidů a barviv. Příkladem mohou být pyrazolony, které se tvoří ze substituovaných fenylhydrazinů a dříve se používaly jako analgetika. S methylaminem reagují diketeny za vzniku N,N'-dimethylacetacetamidu, který se chloruje sulfurylchloridem a následně reaguje s trimethylfosfitem, čímž vzniká vysoce toxický insekticid monokrotofos (obzvláště toxický pro včely). Diketeny rovněž reagují se substituovanými arpmatickými aminy na acetacetanilidy, které jsou prekurzory většiny žlutých, oranžových a červených azobarviv.
Ukázkový příklad pro syntézu arylidů reakcí diketenů s aromatickými aminy je:
Aromatické diazoniové soli reagují s arylidy za vzniku azobarviv jako je například pigmentová žluť 74:
Průmyslová výroba acesulfamu K, používaného jako umělé sladidlo, je založena na reakci diketenů s kyselinou amidosulfonovou a cyklizaci oxidem sírovým.
Bezpečnost
I přes vysokou reaktivitu diketenu jako alkylačního činidla a na rozdíl od podobných β-laktonů propiolaktonu a β-butyrolaktonu diketen nemá karcinogenní účinky, pravděpodobně díky nízké stabilitě jeho DNA adduktů.[8]
Odkazy
Externí odkazy
 Obrázky, zvuky či videa k tématu Diketen na Wikimedia Commons
Obrázky, zvuky či videa k tématu Diketen na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku Diketene na anglické Wikipedii.
- ↑ a b Diketene. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ a b ARPE, Hans-Jürgen. Industrielle organische Chemie: Bedeutende vor- und Zwischenprodukte. 6th. vyd. Weinheim: Wiley-VCH, 2007. Dostupné online. ISBN 3-527-31540-3. S. 200–1. (German)
- ↑ Susana Breda; IGOR REVA; RUI FAUSTO. UV Induced Unimolecular Photochemistry of Diketene Isolated in Cryogenic Inert Matrices. J. Phys. Chem. A. 2012, s. 2131–2140. DOI 10.1021/jp211249k. (anglicky)
- ↑ Rafael Gómez-Bombarelli; MARINA GONZÁLEZ-PÉREZ; MARÍA TERESA PÉREZ-PRIOR; JOSÉ A. MANSO; EMILIO CALLE; JULIO CASADO. Kinetic Study of the Neutral and Base Hydrolysis of Diketene. J. Phys. Org. Chem.. 2008, s. 438–442. DOI 10.1002/poc.1483. (anglicky)
- ↑ Kiran Kumar Solingapuram Sai; THOMAS M. GILBERT; DOUGLAS A. KLUMPP. Knorr Cyclizations and Distonic Superelectrophiles. J. Org. Chem.. 2007, s. 9761–9764. DOI 10.1021/jo7013092. PMID 17999519. (anglicky)
- ↑ Ashford's Dictionary of Industrial Chemicals, Third Edition, 2011, pages 3241-2.
- ↑ Wolf S. Schultz: Sizing Agents in Fine Paper[nedostupný zdroj] Abgerufen am 1. März 2012.
- ↑ Rafael Gómez-Bombarelli; MARINA GONZÁLEZ-PÉREZ; MARÍA TERESA PÉREZ-PRIOR; JOSÉ A. MANSO; EMILIO CALLE; JULIO CASADO. Chemical Reactivity and Biological Activity of Diketene. Chem. Res. Toxicol.. 2008, s. 1964–1969. DOI 10.1021/tx800153j. PMID 18759502. (anglicky)
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Autor: ChemDoc 2010, Licence: CC BY-SA 3.0
Synthesis of Pigment Yellow 74
Autor: ChemDoc 2010, Licence: CC BY-SA 3.0
Acetoacetanilid aus Diketen (Synthese von Aryliden)
Skeletal formula of the diketene molecule, C4H4O2.
Ball-and-stick model of the diketene molecule, C4H4O2.
X-ray crystallographic data from M. I. Kay and L. Katz (December 1958). "A refinement of the crystal structure of ketene dimer". Acta Cryst. 11 (12): 897-898. DOI:10.1107/S0365110X58002565.Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances