Dikyan
| Dikyan | |
|---|---|
 Strukturní vzorec | |
 3D vzorec | |
| Obecné | |
| Systematický název |
|
| Ostatní názvy | dikyan, EDN |
| Anglický název | Cyanogen |
| Německý název | Dicyan |
| Funkční vzorec | (CN)2 |
| Sumární vzorec | C2N2 |
| Vzhled | bezbarvý plyn nebo kapalina |
| Identifikace | |
| Registrační číslo CAS | 460-19-5 |
| EC-no (EINECS/ELINCS/NLP) | 207-306-5 |
| PubChem | 9999 |
| ChEBI | 29308 |
| UN kód | 1026 |
| Číslo RTECS | GT1925000 |
| Vlastnosti | |
| Molární hmotnost | 52,035 g/mol |
| Teplota tání | −27,9 °C |
| Teplota varu | −20,7 °C |
| Hustota | 0,953 7 g/cm³ (−21 °C) 0,002 335 g/cm³ (20 °C) |
| Dynamický viskozitní koeficient | 0,009 28 cP (0 °C) 0,009 87 cP (17 °C) 0,012 71 cP (100 °C) |
| Index lomu | nD= 1,000 82 (0 °C) |
| Kritická teplota Tk | 126,6 °C |
| Kritický tlak pk | 6 009 kPa |
| Rozpustnost ve vodě | 450 ml/100 g (20 °C) |
| Rozpustnost v polárních rozpouštědlech | ethanol 230 ml/100 g (80 °C) |
| Rozpustnost v nepolárních rozpouštědlech | diethylether 500 ml/100 g (18 °C) |
| Van der Waalsovy konstanty stavové rovnice | a= 0,776 9 Pa m6 mol−2 b= 69,01×10−6 m3 mol−1 |
| Ionizační energie | 13,6 eV |
| Struktura | |
| Dipólový moment | 0 Cm |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | 308,15 kJ/mol |
| Standardní molární spalná entalpie ΔH°sp | −1 087,7 kJ/mol |
| Entalpie tání ΔHt | 156 J/g |
| Entalpie varu ΔHv | 448,3 J/g |
| Standardní molární entropie S° | 241,8 J−1 mol−1 |
| Standardní slučovací Gibbsova energie ΔGf° | 197,35 kJ/mol |
| Izobarické měrné teplo cp | 1,092 J K−1 g−1 |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R11, R23, R50/53 |
| S-věty | (S1/2), S23, S45, S60, S61 |
| NFPA 704 | |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
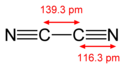
Dikyan je jednou z několika kyanových sloučenin. Tyto sloučeniny se vyznačují buď jednomocným zbytkem –CN nebo aniontem CN−. Volný radikál nemůže ovšem existovat, ale je známa sloučenina dikyan, jejíž vzorec je (CN)2. Atomy uhlíku jsou v ní spojeny trojnými vazbami s atomy dusíku.
Vlastnosti
Dikyan je jedovatý plyn, který voní po hořkých mandlích. Jeho teplota varu je -20,7 °C. Dobře se rozpouští ve vodě a v ethanolu. Jeho spalováním za zvýšeného tlaku s kyslíkem lze dosáhnout namodralého plamene, jehož teplota je asi 4 800 °C (s ozónem pak ještě lehce vyšší). Dikyan je tak uváděn jako plyn s druhou nejvyšší teplotou hoření (po dikyanoacetylenu).
Příprava
Nejsnadněji se dikyan připravuje reakcí koncentrovaných roztoků síranu měďnatého a kyanidu draselného, přičemž v první fázi přípravy vzniklý kyanid měďnatý se v druhé fázi samovolně rozloží:
1. Cu2+ + 2CN− → Cu(CN)2
2. 2Cu(CN)2 → 2CuCN + (CN)2
Dikyan lze také získat rozkladem kyanidu rtuťnatého:
Hg(CN)2 → Hg + (CN)2
Reference
- ↑ a b Cyanogen. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
Literatura
- VOHLÍDAL, Jiří; ŠTULÍK, Karel; JULÁK, Alois. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Externí odkazy
 Obrázky, zvuky či videa k tématu Dikyan na Wikimedia Commons
Obrázky, zvuky či videa k tématu Dikyan na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for toxic substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
Structure of the cyanogen molecule, NCCN, with the C-N bond length of 1.163 Å and the C-C bond length of 1.393 Å. Data from CRC Handbook of Chemistry and Physics, 88th edition.
Space-filling model of the cyanogen molecule, (CN)2.
Gas-phase electron diffraction data from CRC Handbook of Chemistry and Physics, 88th edition.
Image generated in Accelrys DS Visualizer.