Dimer chloridu allylpalladnatého
| Dimer chloridu allylpalladnatého | |
|---|---|
 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | dimer chloridu allylpalladnatého |
| Ostatní názvy | APC |
| Sumární vzorec | C6H10Cl2Pd2 |
| Vzhled | bílé krystaly |
| Identifikace | |
| Registrační číslo CAS | 12012-95-2 |
| EC-no (EINECS/ELINCS/NLP) | 234-579-8 |
| PubChem | 61538 |
| SMILES | Cl[Pd]CC=C.C=CC[Pd]Cl |
| InChI | 1S/2C3H5.2ClH.2Pd/c2*1-3-2;;;;/h2*3H,1-2H2;2*1H;;/q;;;;2*+1/p-2 |
| Vlastnosti | |
| Molární hmotnost | 365,89 g/mol |
| Teplota rozkladu | 155 až 156 °C (428 až 429 K) |
| Rozpustnost ve vodě | nerozpustný |
| Rozpustnost v polárních rozpouštědlech | rozpustný v acetonu, methanolu a chloroformu |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v benzenu |
| Bezpečnost | |
| [1] | |
| H-věty | H302 H315 H319 H335[1] |
| P-věty | P261 P264 P270 P271 P280 P301+312 P302+352 P304+340 P305+351+338 P312 P321 P330 P332+313 P337+313 P362 P403+233 P405 P501[1] |
Některá data mohou pocházet z datové položky. | |
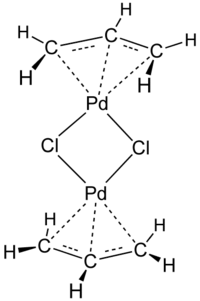
Dimer chloridu allylpalladnatého (APC) je komplexní sloučenina se vzorcem [(η3-C3H5)PdCl]2. Používá se jako katalyzátor v organické syntéze.[2] Patří k nejpoužívanějším allylovým komplexům přechodných kovů.
Struktura
Tato sloučenina má dimerní centrosymetrickou strukturu. Každá allylová skupina leží v rovině, která tvoří se čtvercem vymezeným atomy palladia a uhlíku úhel 111,5°, délky všech vazeb Pd–C jsou stejné. Elementární buňka je monoklinická.[3]
Příprava
Tento komplex se připravuje reakcí oxidu uhelnatého s roztokem tetrachloropalladnatanu sodného (získaného z chloridu palladnatého a chloridu sodného) ve směsi vody a methanolu a s allylchloridem.[2]
- 2 Na2PdCl4 + 2 CH2=CHCH2Cl + 2 CO + 2 H2O → [(η3-C3H5)PdCl]2 + 4 NaCl + 2 CO2 + 4 HCl
Další možností je reakce propenu s trifluoroctanem palladnatým a následná výměna iontů za chlorid:[4]
- 2 (CF3COO)2Pd + 2 CH2=CHCH3 → [(η3-C3H5)Pd(CF3COO)]2
- [(η3-C3H5)Pd(CF3COO)]2 + 2 Cl− → [(η3-C3H5)PdCl]2 + 2 CF3COO−
Reakce
APC reaguje se zdroji cyklopentadienylových aniontů za vzniku příslušných 18elektronových komplexů cyklopentadienylallylpalladia:
- [(η3-C3H5)PdCl]2 + 2 NaC5H5 → 2 [(η5-C5H5)Pd(η3-C3H5)] + 2 NaCl
Dimer může reagovat s mnoha různými Lewisovými zásadami (:B) za vzniku aduktů (η3-C3H5)PdCl:B. S pyridinem reaguje podle této rovnice:
- 1/2 [(η3-C3H5)PdCl]2 + :NC5H5 → (η3-C3H5)PdCl:NC5H5 ΔH=−30,1 kJ/mol
Uvedená změna entalpie odpovídá vzniku jednoho molu produktu, (η3-C3H5)PdCl:NC5H5, z dimeru kyseliny. Disociační energie palladnatého dimeru, tedy energie působící před reakcí s donorem:
- [(η3-C3H5)PdCl]2 → 2 (η3-C3H5)PdCl
je 28 kJ/mol.
APC katalyzuje řadu organických reakcí, jako jsou křížová párování, nukleofilní adice na dieny a rozklad diazosloučenin na reaktivní karbeny. Jedná se též o prekurzor dalších katalyzátorů založených na palladiu.[4]
Reference
V tomto článku byl použit překlad textu z článku Allylpalladium chloride dimer na anglické Wikipedii.
- ↑ a b c https://pubchem.ncbi.nlm.nih.gov/compound/61538
- ↑ a b Tatsuno, Y.; Yoshida, T.; Otsuka, S. "(η3-allyl)palladium(II) Complexes" Inorganic Syntheses, 1990, volume 28, pages 342-345. ISBN 0-471-52619-3
- ↑ A. E. Smith. The structure of the allylpalladium chloride complex (C3H5PdCl)2 at –140 °C. Acta Crystallographica. 1965, s. 331–340. Dostupné online. ISSN 0365-110X. DOI 10.1107/S0365110X65000774.
- ↑ a b Stephen A. Godleski; Véronique Michelet; Jean-Pierre Genêt. Encyclopedia of Reagents for Organic Synthesis. Chichester, UK: John Wiley & Sons, 2006. Dostupné online. ISBN 978-0-471-93623-7. DOI 10.1002/047084289x.rb098s.pub2. Kapitola Bis(allyl)di-μ-chlorodipalladium.
Externí odkazy
 Obrázky, zvuky či videa k tématu Dimer chloridu allylpalladnatého na Wikimedia Commons
Obrázky, zvuky či videa k tématu Dimer chloridu allylpalladnatého na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Model molekuly dimeru chloridu allylpalladnatého
structure of allyl palladium dimer



