Dimer dikarbonylu cyklopentadienylželeza
| Dimer dikarbonylu cyklopentadienylželeza | |
|---|---|
 Strukturní vzorec | |
 Model molekuly trans izomeru | |
 Model molekuly cis izomeru | |
| Obecné | |
| Systematický název | dimer dikarbonylu cyklopentadienylželeza |
| Funkční vzorec | [(η5-C5H5)Fe(CO)2]2 |
| Sumární vzorec | C14H10O4Fe2 |
| Vzhled | tmavě fialové krystaly |
| Identifikace | |
| Registrační číslo CAS | 12154-95-9 |
| EC-no (EINECS/ELINCS/NLP) | 235-276-3 |
| PubChem | 11110989 |
| SMILES | C-]#[O+].[C-]#[O+].c1ccc[cH-]1.[Fe+][C-]=O.c1ccc[cH-]1.[Fe+][C-]=O |
| InChI | 1S/2C5H5.4CO.2Fe/c2*1-2-4-5-3-1;4*1-2;;/h2*1-5H;;;;;;/q;;;;2*-1;2*+1 |
| Vlastnosti | |
| Molární hmotnost | 353,92 g/mol |
| Teplota tání | 194 °C (467 K) |
| Teplota varu | rozkládá se |
| Hustota | 1,77 g/cm3 |
| Rozpustnost ve vodě | nerozpustný |
| Rozpustnost v polárních rozpouštědlech | rozpustný v tetrahydrofuranu |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v benzenu |
Některá data mohou pocházet z datové položky. | |
Dimer dikarbonylu cyklopentadienylželeza je organokovová sloučenina se vzorcem [(η5-C5H5)Fe(CO)2]2, zkráceně Cp2Fe2(CO)4, [CpFe(CO)2]2 nebo Fp2. Jedná se o tmavě fialovou pevnou látku rozpustnou v mírně polárních organických rozpouštědlech, jako jsou chloroform a pyridin, a méně v teterachlomethanu a sirouhlíku. Ve vodě je nerozpustný, ale nereaguje s ní. Cp2Fe2(CO)4 jer dostatečně stálý, aby mohl být skladován za přítomnosti vzduchu a používá se na přípravu dalších komplexů CpFe(CO)2.[1]
Struktura
V roztocích Cp2Fe2(CO)4 vytváří dimerní polosendvičový komplex. Vytváří tři izomery: cis, trans a otevřenou formu, neobsahující můstek; tyto izomery lze odlišit podle polohy ligandů. Cis a trans izomer se liší vzájemnou polohou C5H5 (Cp) ligandů; označují se strukturním vzorcem [(η5-C5H5)Fe(CO)(μ-CO)]2, takže dva CO ligandy jsou koncové a zbylé dva tvoří můstek mezi atomy železa. Cis a trans izomery se vzájemně přeměňují s nemůstkovým izomerem, který můstkové ligandy mezi atomy železa nemá, jeho vzorec se zapisuje jako (η5-C5H5)(OC)2Fe−Fe(CO)2(η5-C5H5) — atomy kovu mají vazbu mezi sebou. V rovnovážném stavu převažují cis a trans izomery.
Koncové a můstkové karbonyly se také navzájem vyměňují: trans izomer je může vyměňovat přes otevřený izomer, případně otočením bez průchodu přes otevřený izomer. U cis izomeru je možný pouze první z těchto mechanismů.[2]
V roztocích se cis, trans a otevřený izomer rychle přeměňují jeden v druhý. Tento proces je příliš rychlý, než aby jej bylo možné zachytit NMR, takže se ve spektru z 1 při 25 °C objevuje jediný signál. Podobně 13 objevuje jeden ostrý CO signál za teplot nad −10 °C, Cp signál se mění na jeden ostrý při 60 °C. NMR studiemi bylo zjištěno, že cis izomer je při pokojové teplotě o něco více zastoupen než trans izomer a podíl otevřené formy je malý.[2] Vzájemná přeměna izomerů není dostatečně rychlá, aby vytvořila jediný pás v infračerveném spektru, kde jsou tak vidět tři pásy. Můstkové CO ligandy absorbují okolo 1780 cm−1 a koncové okolo 1980 cm−1.[3]
Průměr struktur Cp2Fe2(CO)4 vytváří v benzenu dipólový moment 3,1 D.[4]
Molekulové struktury cis i trans izomerů v pevném skupenství byly prozkoumány rentgenovou a neutronovou difrakcí. Vzdálenosti Fe–Fe a Fe–C se v rámci kosodélníku Fe2C2 neliší, Fe2C2 vytváří u trans izomeru přesně rovinný systém a u cis izomeru se objevuje kosodélník složený o úhel 164°, odchylky ve struktuře Cp kruhu trans izomeru jsou způsobeny rozdílným obsazením orbitalů Cp.[5]
I když jsou ve starších publikacích znázorňovány dva vzájemně propojené atomy železa, tak teoretické analýzy přítomnost přímých vazeb Fe–Fe nepodporují, což odpovídá výpočetním i krystalografickým datům, které neukazují na výši elektronovou hustotu na atomech železa.[6]
Jiný pohled, založený hlavně na reaktivitě a spektroskopických údajích, naznačuje, že elektronová hustota nemusí být nejlepším ukazatelem přítomnosti či nepřítomnosti chemické vazby. Za nepřítomnosti vazby Fe–Fe by můstkové karbonyly musely formálně být μ-X2 a μ-L ligandy, aby Fe centra splňovala pravidlo 18 elektronů.[7]
Příprava
Cp2Fe2(CO)4 poprvé připravil Geoffrey Wilkinson v roce 1955 způsobem, který se dosud používá: reakcí pentakarbonylu železa (Fe(CO)5) s dicyklopentadienem.[7][8]
- 2 Fe(CO)5 + C10H12 → (η5-C5H5)2Fe2(CO)4 + 6 CO + H2
Dicyklopentadien se zde štěpí na cyklopentadien, který poté reaguje s Fe(CO)5 za ztráty CO. Fotochemický a tepelný mechanismus jsou poněkud odlišné, ovšem v obou se vytváří hydridový meziprodukt.[5]
Reakce
Přestože nemá Fp2 žádné využití mimo laboratoře, tak se používá na přípravu dalších organokovových sloučenin.
Fp− (FpNa a FpK)
Redukčním štěpením [CpFe(CO)2]2 (komplexu Fe+) vznikají sloučeniny alkalických kovů formálně odvozené od cyklopentadienyldikarbonylželezného aniontu, [CpFe(CO)2]−, nebo Fp−obsahujícího Fe0, u nichž se předpokládá, že tvoří těsné iontové páry. Obvyklým redukčním činidlem bývá kovový sodík nebo sodný amalgam,[9] slitina NaK, grafit draselný (KC8), nebo trialkylborohydrid kovu alkalických zemin. [CpFe(CO)2]Na je často zkoumanou sloučeninou, protože se snadno alkyluje, acyluje či metaluje pomocí odpovídajících elektrofilů.[10] Jedná se o velmi dobrý SN2 nukleofil, v reakcích s primárními a sekundárními alkylbromidy přibližně o dva řády nukleofilnější než thiofenolátový anion, PhS–.[11]
- [CpFe(CO)2]2 + 2 Na → 2 CpFe(CO)2Na
- [CpFe(CO)2]2 + 2 KBH(C2H5)3 → 2 CpFe(CO)2K + H2 + 2 B(C2H5)3
Reakcí NaFp s alkylhalogenidy (RX, X = Br, I) vznikají sloučeniny FeR(η5-C5H5)(CO)2
- CpFe(CO)2K + CH3I → CpFe(CO)2CH3 + KI
Fp2 lze také štěpit alkalickými kovy[12] a elektrochemickou redukcí.[13][14]
FpX (X = Cl, Br, I)
Halogeny oxidačně štěpí [CpFe(CO)2]2 na železnaté sloučeniny FpX (X = Cl, Br, I),
- [CpFe(CO)2]2 + X2 → 2 CpFe(CO)2X
jako je například jodid cyklopentadienyldikarbonylželeznatý.
Fp(η2-alken)+, Fp(η2-alkyn)+ a ostatní Fp+
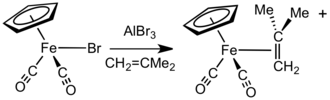
Za přítomnosti halogenidových aniontů akceptory, jako jsou bromid hlinitý a tetrafluorboritan stříbrný, reagují sloučeniny typu FpX (X = halogenid) s alkeny, alkyny, a labilními neutrálními ligandy (například ethery a nitrily) za vzniku komplexů Fp+.[15]
[Fp(isobuten)]+ lze připravit reakcí NaFp s methallylchloridem a následnou protonolýzou. Tento komplex se dá použít jako prekurzor dalších kationtových Fp–alkenů a Fp–alkynů.[16] Při této výměně se uvolňuje plynný isobuten.[17] Méně substituované alkeny se vážou silněji a mohou nahradit více stericky zatížené ligandy.
Alkenové a alkynové komplexy mohou být také vytvořeny zahříváním kationtových etherových nebo aquakomplexů, například [Fp(thf)]+BF −
4 , s alkeny a alkyny.[18]
Komplexy [FpL]|+BF −
4 lze rovněž získat z FpMe a HBF4·Et2O v dichlormethanu při −78 °C a navázání ligandu na produkt této reakce.[19]
Komplexy Fp a alkenů lze též získat nepřímo z Fp aniontů. Odštěpením hydridů z Fp–alkylových sloučenin pomocí trifenylmethylhexafluorofosfátu vznikají komplexy [Fp(α-alken)]+.
- FpNa + RCH2CH2I → FpCH2CH2R + NaI
- FpCH2CH2R + Ph3CPF6 → [Fp(CH2=CHR)+]PF −
6 + Ph3CH - FpCH2CH2R + Ph3CPF6 → [Fp(CH2=CHR)+]PF −
I reakcemi NaFp s epoxidy následovanými kysele řízenými dehydratacemi je možné vytvořit komplexy alkenů. Fp(alken)+ jsou stálé vůči bromacím, hydrogenacím a acetoxymerkuracím, alken lze ovšem snadno odstranit působením jodidu sodného v acetonu nebo zahříváním s acetonitrilem.[20]
Alkenové ligandy jsou u těchto aniontů aktivované vůči nukleofilním atakům, což jim umožňuje vstupovat do řady reakcí vytvářejících vazby mezi atomy uhlíku. Nukleofilní adice obvykle probíhají na substituovanějším uhlíku; tato regioselektivita je způsobena větší hustotou kladného náboje. Adice nukleofilů jsou zcela stereoselektivní, probíhají do polohy anti vůči skupině Fp. Obdobně mohou i komplexy typu Fp(alkyn)+ vstupovat do nukleofilních adičních reakcí s mnoha uhlíkatými, dusíkatými a kyslíkatými nukleofily.[21]
Fp(alken)+ a Fp(alkyn)+ π komplexy jsou také kyselé na allylových a propargylových pozicích a mohou být kvantitativně deprotonovány aminovými zásadami, jako je triethylamin, na neutrální Fp–allyl and Fp–allenyl σ komplexy.[16]
- (1) Fp(H2C=CHCH2CH3)+|BF −
4 + Et3N → FpCH2CH=CHCH3 + Et3NH+BF −
4
- (2) FpCH2CH=CHCH3 + E+BF −
4 → Fp(H2C=CHCH(E)CH3)+BF −
4
Fp–allylové al d Fp–allenylové loučeniny reagují s kationtovými elektrofily E (například trimethyloxoniumtetrafluorborátem (Me3O+), karbokationty a oxokarbeniovými ionty) za tvorby allylovaných a propargylovaných produktů.[16] Podobný komplex [Cp*Fe(CO)2(thf)]+[BF4]− katalyzuje navazování propargylových a allylových skupina na vazby C−H spojením deprotonace a elektrofilní funkcionalizace.[22]
Byly také popsány η2-allenylové komplexy Fp+ a substituované cyklopentadienyldikarbonylželeznaté kationty, přičemž vykazují výrazné odchýlení na centrálním allenovém uhlíku (s vazebným úhlem < 150°).
Cyklopropanační činidla obsahující Fp
Byla vyvinuta cyklopropanační činidla založená na Fp.[25] Připravují se reakcemi FpNa s thioethery a jodmethanem a jsou stálejší než obvyklé Simmonsovy–Smithovy meziprodukty a diazoalkany.
- FpNa + ClCH2SCH3 → FpCH2SCH3 + NaCl
- FpCH2SCH3 + CH3I + NaBF4 → FpCH2S(CH3)2]BF4 + NaI
K používání [FpCH2S(CH3)2]BF4 nejsou potřeba zvláštní podmínky.
- Fp(CH2S+(CH3)2>BF −
4 + (Ph)2C=CH2 → 1,1-difenylcyklopropan + …
K odstranění vedlejších produktů se přidává chlorid železitý.
Jako cyklopropanační činidla také někdy slouží prekurzory Fp=CH +
2 , jako je FpCH2OMe, protonací se měnící na karben.[26]
Fotochemické reakce
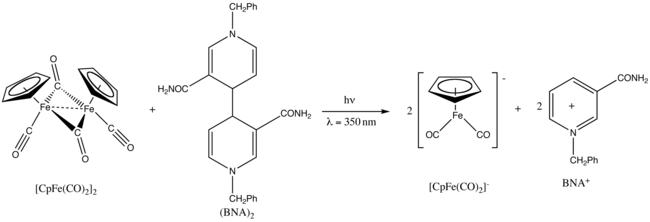
Fp2 vstupuje do fotochemických reakcí.[27]
Ozáření ultrafialovým zářením o vlnové délce 350 nm vyvolává redukci dimeru 1-benzyl-1,4-dihydronikotinamidu, (BNA)2.[28]
Reference
V tomto článku byl použit překlad textu z článku Cyclopentadienyliron dicarbonyl dimer na anglické Wikipedii.
- ↑ William J. Kelly. Encyclopedia of Reagents for Organic Synthesis. [s.l.]: [s.n.], 2001. ISBN 0471936235. DOI 10.1002/047084289X.rb139. Kapitola Bis(dicarbonylcyclopentadienyliron).
- ↑ a b Daniel C. Harris; Edward Rosenberg; John D. Roberts. Carbon-13 nuclear magnetic resonance spectra and mechanism of bridge–terminal carbonyl exchange in di-µ-carbonyl-bis[carbonyl(η-cyclopentadienyl)iron](Fe–Fe) [{(η-C5H5)Fe(CO)2}2]; cd-di-µ-carbonyl-f-carbonyl-ae-di(η-cyclopentadienyl)-b-(triethyl-phosphite)di-iron(Fe–Fe) [(η-C5H5)2Fe2(CO)3P(OEt)3], and some related complexes. Journal of the Chemical Society: Dalton Transactions. 1974, s. 2398–2403. Dostupné online. ISSN 0300-9246. DOI 10.1039/DT9740002398.
- ↑ G. Girolami; T. Rauchfuss; R. Angelici. Synthesis and Technique in Inorganic Chemistry. [s.l.]: University Science Books, 1999. Dostupné online. ISBN 978-0-935702-48-4.
- ↑ F. Albert Cotton; G. Yagupsky. Tautomeric changes in metal carbonyls. I. .pi.-Cyclopentadienyliron dicarbonyl dimer and .pi.-cyclopentadienyl-ruthenum dicarbonyl dimer. Inorganic Chemistry. 1967. Dostupné online. ISSN 0020-1669. DOI 10.1021/ic50047a005.
- ↑ a b Geoffrey Wilkinson. Comprehensive Organometallic Chemistry. [s.l.]: Pergamon Press, 1982. ISBN 978-0-08-025269-8.
- ↑ Jennifer C. Green; Malcolm L. H. Green; Gerard Parkin. The occurrence and representation of three-centre two-electron bonds in covalent inorganic compounds. Chemical Communications. 2012, s. 11481–11503. DOI 10.1039/c2cc35304k. PMID 23047247.
- ↑ a b Jay A. Labinger. Does cyclopentadienyl iron dicarbonyl dimer have a metal–metal bond? Who's asking?. Inorganica Chimica Acta. 2015, s. 14–19. ISSN 0020-1693. DOI 10.1016/j.ica.2014.04.022.
- ↑ T. S. Piper; F. A. Cotton; G. Wilkinson. Cyclopentadienyl–carbon monoxide and related compounds of some transitional metals. Journal of Inorganic and Nuclear Chemistry. 1955, s. 165–174. DOI 10.1016/0022-1902(55)80053-X.
- ↑ CHANG, T. C. T.; ROSENBLUM, M.; SIMMS, N. Vinylation of Enolates with a Vinyl Cation Equivalent: trans-3-Methyl-2-Vinylcyclohexanone. Org. Synth.. 1988, s. 95. Dostupné online. (anglicky); Coll. Vol.. S. 479. (anglicky)
- ↑ B. King. Applications of Metal Carbonyl Anions in the Synthesis of Unusual Organometallic Compounds. Accounts of Chemical Research. 1970, s. 417–427. DOI 10.1021/ar50036a004.
- ↑ Raymond E. Dessy; Rudolph L. Pohl; R. Bruce King. Organometallic Electrochemistry. VII.1 The Nucleophilicities of Metallic and Metalloidal Anions Derived from Metals of Groups IV, V, VI, VII, and VIII. Journal of the American Chemical Society. 1966-11-01, s. 5121–5124. Dostupné online. ISSN 0002-7863. DOI 10.1021/ja00974a015.
- ↑ J. E. Ellis; E. A. Flom. The Chemistry of Metal Carbonyl Anions: III. Sodium-Potassium Alloy: An Efficient Reagent for the Production of Metal Carbonyl Anions. Journal of Organometallic Chemistry. 1975, s. 263–268. DOI 10.1016/S0022-328X(00)88455-7.
- ↑ R. E. Dessy; R. B. King; M. Waldrop. The Organometallic Electrochemistry. V. The Transition Series. Journal of the American Chemical Society. 1966, s. 5112–5117. DOI 10.1021/ja00974a013.
- ↑ R. E. Dessy; P. M. Weissman; R. L. Pohl. Organometallic Electrochemistry. VI. Electrochemical Scission of Metal–Metal Bonds. Journal of the American Chemical Society. 1966, s. 5117–5121. DOI 10.1021/ja00974a014.
- ↑ J. Silver. Chemistry of Iron. Dordrecht: Springer Netherlands, 1993. ISBN 9789401121408.
- ↑ a b c CUTLER, A.; EHNHOLT, D.; LENNON, P.; NICHOLAS, K.; MARTEN, David F.; MADHAVARAO, M.; RAGHU, S. Chemistry of dicarbonyl .eta.5-cyclopentadienyliron complexes. General syntheses of monosubstituted η2-olefin complexes and of 1-substituted η1-allyl complexes. Conformational effects on the course of deprotonation of (η2-olefin) cations. Journal of the American Chemical Society. 1975, s. 3149–3157. ISSN 0002-7863. DOI 10.1021/ja00844a038. (anglicky)
- ↑ Mark M. Turnbull. Encyclopedia of Reagents for Organic Synthesis. [s.l.]: [s.n.], 2001. ISBN 0471936235. DOI 10.1002/047084289X.rd080. Kapitola Dicarbonyl(cyclopentadienyl)(isobutene)iron Tetrafluoroborate.
- ↑ D. F. Schriver; M. I. Bruce; G. Wilkinson. Iron, Ruthenium and Osmium. [s.l.]: Elsevier Science, 1995. ISBN 978-0-08-096396-9.
- ↑ Mark D. Redlich; Michael F. Mayer; M. Mahmun Hossain. Iron Lewis Acid [(η5-C5H5)Fe(CO)2(THF)]+ Catalyzed Organic Reactions. Aldrichimica Acta. 2003, s. 3–13.
- ↑ A. J. Pearson. Iron Compounds in Organic Synthesis. [s.l.]: Academic Press, 1994. Dostupné online. ISBN 978-0-12-548270-7. S. 22–35.
- ↑ Munetaka Akita; Satoshi Kakuta; Shuichiro Sugimoto; Masako Terada; Masako Tanaka; Yoshihiko Morooka. Nucleophilic Addition to the η2-Alkyne Ligand in [CpFe(CO)2(η2-R−C⋮C−R)]+. Dependence of the Alkenyl Product Stereochemistry on the Basicity of the Nucleophile. Organometallics. 2001, s. 2736–2750. ISSN 0276-7333. DOI 10.1021/om010095t.
- ↑ a b c Yidong Wang; Jin Zhu; Austin C. Durham; Haley Lindberg; Yi-Ming Wang. α-C–H Functionalization of π-Bonds Using Iron Complexes: Catalytic Hydroxyalkylation of Alkynes and Alkenes. Journal of the American Chemical Society. 2019, s. 19594–19599. ISSN 0002-7863. DOI 10.1021/jacs.9b11716. PMID 31791121.
- ↑ Yidong Wang, Sarah G. Scrivener, Xiao-Dong Zuo, Ruihan Wang, Philip N. Palermo, Ethan Murphy, Austin C. Durham, Yi-Ming Wang. Iron-Catalyzed Contrasteric Functionalization of Allenic C(sp 2 )–H Bonds: Synthesis of α-Aminoalkyl 1,1-Disubstituted Allenes. Journal of the American Chemical Society. 2021-09-22, s. 14998–15004. ISSN 0002-7863. DOI 10.1021/jacs.1c07512. PMID 34491051.
- ↑ Bruce M. Foxman. X-Ray molecular structure of dicarbonyl-η5-cyclopentadienyl-(η2-tetramethylallenyl)iron tetrafluoroborate. A sterically crowded allene complex. Journal of the Chemical Society, Chemical Communications. 1975-01-01, s. 221–222. Dostupné online. ISSN 0022-4936. DOI 10.1039/C39750000221.
- ↑ MATTSON, M. N.; O'CONNOR, E. J.; HELQUIST, P. Cyclopropanation Using an Iron-Containing Methylene Transfer Reagent: 1,1-Diphenylcyclopropane. Org. Synth.. 1992, s. 177. Dostupné online. (anglicky); Coll. Vol.. S. 372. (anglicky)
- ↑ M. D. Johnson. Comprehensive Organometallic Chemistry. [s.l.]: Elsevier, 1975-01-01. ISBN 978-0-08-046518-0. DOI 10.1016/b978-008046518-0.00049-0. Kapitola Mononuclear Iron Compounds with η1-Hydrocarbon Ligands, s. 331–376.
- ↑ M. Wrighton. Photochemistry of Metal Carbonyls. Chemical Reviews. 1974, s. 401–430. DOI 10.1021/cr60290a001.
- ↑ S. Fukuzumi; K. Ohkubo; M. Fujitsuka; O. Ito; M. C. Teichmann; E. Maisonhaute; C. Amatore. Photochemical Generation of Cyclopentadienyliron Dicarbonyl Anion by a Nicotinamide Adenine Dinucleotide Dimer Analogue. Inorganic Chemistry. 2001, s. 1213–1219. DOI 10.1021/ic0009627. PMID 11300821.
Externí odkazy
 Obrázky, zvuky či videa k tématu Dimer dikarbonylu cyklopentadienylželeza na Wikimedia Commons
Obrázky, zvuky či videa k tématu Dimer dikarbonylu cyklopentadienylželeza na Wikimedia Commons
Média použitá na této stránce
Ball-and-stick model of the cis isomer of the cyclopentadienyliron dicarbonyl dimer, C14H10Fe2O4, AKA Cp2Fe2(CO)4 or Fp2.
Colour code:
- Carbon, C: grey-black
- Hydrogen, H: white
- Iron, Fe: purple-grey-blue
- Oxygen, O: red
Structure determined by X-ray crystallography and reported in J. Chem. Soc. A (1970) 3068–3074 (CPFECO10).
Model manipulated in CrystalMaker 8.7.
Image generated in Accelrys DS Visualizer.Autor: Smokefoot, Licence: CC BY-SA 3.0
Main isomer of Fp2, without the Fe-Fe bond
Autor: Alsosaid1987, Licence: CC BY-SA 4.0
cis-trans-open form isomerizations of Fp2
(c) Epark from en.wikipedia.org, CC BY-SA 3.0
1-benzyl-1,4-dihydronicotinamide dimer, aka, (BNA)2 Created by using Chem Draw
Ball-and-stick model of the trans isomer of the cyclopentadienyliron dicarbonyl dimer, C14H10Fe2O4, AKA Cp2Fe2(CO)4 or Fp2.
Colour code:
- Carbon, C: grey-black
- Hydrogen, H: white
- Iron, Fe: purple-grey-blue
- Oxygen, O: red
Structure (determined by X-ray crystallography) from a private communication to the Cambridge Structural Database by M. Nieger. CCDC deposition number 715749, refcode CYPFEC04.
Model manipulated in CrystalMaker 8.7.
Image generated in Accelrys DS Visualizer.Autor: unknown, Licence:


![Adice karboaniontu na [Fp(alken)]+](http://upload.wikimedia.org/wikipedia/commons/thumb/7/7e/FpMalonateRxn.png/330px-FpMalonateRxn.png)