Dimerní alkylketeny

Dimerní alkylketeny nebo alkylketenové dimery (zkráceně AKD) jsou organické sloučeniny, jejichž molekuly obsahují čtyřuhlíkaté řetězce tvořené oxetan-2-onovými cykly, které jsou také základními strukturními jednotkami propiolaktonů a diketenů. Na oxetanový kruh bývají obvykle napojeny 12- až 16uhlíkové alkylové skupiny v pozici 3 a 13- až 17uhlíkové alkylidenové skupiny v pozici 4.
Dimery alkylovaných ketenů se nejčastěji používají při šlichtování papíru nebo hydrofobizaci vláken celulózy. Takto vytvořené materiály jsou odolnější vůči mechanickému namáhání a méně propouštějí vodu a inkousty.[1]
AKD mají hydrofobní alkylové skupiny navázané na beta-propiolaktonový kruh; příkladem je dimerní keten odvozený od kyseliny stearové; ten se připravuje pyrolýzou steraroylchloridu.[2] AKD reagují s hydroxylovými skupinami v celulóze za vzniku esterů. Tato esterifikace probíhá současně s hydrolýzou AKD. Před vyvinutím dimerních alkylketenů se ke zvýšení hydrofobicity papíru používala kalafuna.[3]
Dimerním alkylketenům se podobají alkenylsukcinanhydridy (ASA). Podobně jako AKD reagují s celulózou za tvorby esterů a připojení hydrofobní skupiny. ASA se připravují enovými reakcemi alkenů s maleinanhydridem.[4]
Historie
V roce 1901 Edgar Wedekind popsal přípravu dimerních alkylketenů reakcí acylchloridů s terciárními aminy.[5][6]
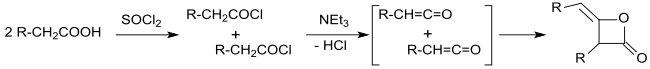
Z určení molekulových hmotností vyplynulo, že produkt obsahuje opakující se skupiny R1R2CH=C=O; bylo tak navrženo, že produkt má strukturu pyrononu (diketonu s cyklobutanovým jádrem)[7] - příkladem může být reakce isobutyrylchloridu a triethylaminu.[8]

Hermann Staudinger[9][10] a Norman Thomas Mortimer Wilsmore[11] zjistili, že hlavními produkty reakce acylchloridů s vodíkovými atomy v pozicích α a terciárními aminy jsou keteny (ethenony), které vytváří 2-oxetanony s alkylidenovými substituenty dimerizacemi prostřednictvím [2+2] fotocykloadicí. Tento objev znamenal ujasnění struktury alkylovaných dimerů ketenů.
Určení izomerie produktů je ztíženo možností vzniku více různých látek; například jednoduché keteny (jako je H2C=C=O) se dimerizují na diketeny (v tomto případě (4-methylidenoxetan-2-on), zatímco ze substituovaných ketenů (jako je dimethylketen, Me2C=C=O, získaný reakcí isobutyrylchloridu s triethylaminem) se tvoří substituované produkty (zde 2,2,4,4-tetramethylcyklobutan-1,3-dion).[7][12]
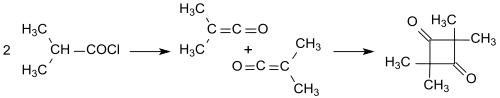
Takto připravený tetramethylcyklobutan-1,3-dion lze snadno izomerizovat za vzniku dimeru dimethylketenu (4-isopropyliden-3,3-dimethyloxetan-2-onu).[13]

Příprava dimeru hexadecylketenu, důležitého alkylketendimeru používabého v papírenském průmyslu, bylo nejprve popsáno v roce 1945 jako patent[14] a o dva roky později i v odborném tisku.[15]
Kvantově mechanickými studiemi byla vyvrácena možnost tvorby cyklobutandionu v průběhu dimerizace n-alkylketenů (R-CH=C=O), místo toho se tvoří stabilnější produkt obsahující oxetan-2-onovou skupinu.[16]
Výroba
V roce 1945 byla patentována průmyslová výroba dimerních alkylketenů z chloridů karboxylových kyselin s dlouhými řetězci a triethylaminu v inertních rozpouštědlech (jako například diethyletheru nebo benzenu). Po odfiltrování nerozpustného triethylamin-hydrochloridu a odpaření rozpouštědla vznikají alkylketenové dimery s výtěžností nad 90 %.[14]
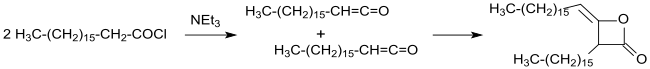
Použití jiných rozpouštědel, například esterů nebo ketonů, za účelem snadnějšího oddělování hydrochloridů triethylaminu či jiných aminů (například N,N,N',N'-tetramethylhexan-1,6-diaminu neposkytuje výhody oproti ostatním postupům.[17]
Byly také popsány metody, při kterých se nevyužívají rozpouštědla; hydrochlorid aminu se buď odfiltruje nebo odstraní pomocí zředěného vodného roztoku kyseliny.[18]
Nepřetržitým procesem, při kterém jsou chloridy karboxylových kyselin s dlouhými řetězci a terciární aminy (například dimethylisopropylamin, dimethylcyklohexylamin nebo triethylamin) odděleně dodávány do reaktoru a reagují za teploty 90 až 110 °C se za krátkou dobu vytváří laktony s více než 90% výtěžností.[19]
Použití
Úprava papíru
K vyřešení potíží souvisejících s kysele (síranem hlinitým) řízeným šlichtováním papíru pomocí kalafunových pryskyřic a zásaditých vločkovacích činidel, jako je uhličitan vápenatý, byly vyvinuty materiály použitelné v neutrálním nebo zásaditém prostředí. Oproti s výrazně reaktivnějším alkylsukcinanhydridům (ASA), které se za přítomnosti vody rychle hydrolyzují, se AKD upřednostňují od 60. let 20. století.[20]

Průmyslově používané AKD bývají odvozené od mastných kyselin s 14 (kyselina myristová) až 22 (kyselina behenová) atomy uhlíku; nejčastější jsou palmityl- (16 uhlíků) a stearylketeny (18 uhlíků) a jejich směsi a také směsi mastných kyselin získaných hydrolýzou rostlinných i živočišných tuků. Tyto mastné kyseliny jsou voskovité pevné látky s teplotami tání mezi 42 a přibližně 70 °C. Směsi alkylketenových dimerů tvoří disperze při teplotách do 40 °C a emulze nad 45 °C. Kapalné AKD, založené na nenasycených nebo rozvětvených mastných kyselinách, se příliš nepoužívají.
Vodní disperze obvykle obsahují 10 až 20 % AKD aktivní ochranné koloidy (často polykationty jako kopolymery N-vinylpyrrolidonu a kvaternozovaného N, acylované polyethyleniminy nebo kationtové polyakrylamidy s vysokou molekulární hmotností až okolo 7 milionů g/mol) a další stabilizátory (často aniontové tenzidy, například lignosulfonáty nebo produkty kondenzace sodné soli kyseliny naftalensulfonové s formaldehydem).[21] Takto stabilizované disperze AKD jsou při pokojové teplotě aktivní a stabilní po dobu tří měsíců a lze do nich dodávat i různé přísady (například kaolin, mastek, křídu, oxid titaničitý, síran vápenatý a oxid hlinitý) v množství 5 až 25 %. Množství dimerních alkylketenů použitých při úpravě papíru se obvykle pohybuje od 0,15 do 0,8 hmotnostních procent, někdy od 0,05 do 0,2 % vzhledem k hmotnosti suché papíroviny.[19]
Šlichtování papíru pomocí AKD
Šlichtování papíru s využitím AKD probíhá ve třech krocích.[22] Úroveň hydrofobicity papíru ovlivňují tyto faktory:
- zadržování částic AKD na mokrém papíru
- rozptýlení částic AKD po povrchu a jejich průnik do hmoty papíru
- reakce hydroxylových skupin celulózy (esterifikace) s alkylovanými dimerními keteny za vzniku beta-ketokarboxylových esterů.

Na výsledek procesu mají vliv molekulová struktura AKD, molární hustota náboje kationtových skupin, přesné množství kationtového polymeru, teplota a pH.
Po odstranění přebytečné vody, která by způsobovala hydrolýzu AKD na beta-ketokarboxylové kyseliny a následné dekarboxylaci na ketony,

následuje štěpení stabilizovaných částic AKD, jejich rozpouštění (při teplotě kolem 90 °C), difúze kapalných AKD po povrchu a tvorba hydrofobních vrstev. Tloušťka těchto vrstev závisí na koncentraci AKD v disperzi.[23]
Hydrofobizace vláken celulózy dimerními alkylketeny nejlépe probíhá v neutrálním a slabě zásaditém prostředí (pH 7,5 až 9,0) za teploty 90 až 110 °C, kdy s celulózou reaguje kolem 40 % použitých AKD.[22] Hodnota kontaktního úhelu po reakci je vyšší než 100°, což ukazuje na hydrofobní charakter.[22]
Alkylketenové dimery se využívají k hydrofobizaci papíru určeného na tištění a psaní a lepenky sloužící na výrobu nápojových kartonů.
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Alkyl ketene dimer na anglické Wikipedii.
- ↑ AKD, Alkylketene Dimer [online]. Dostupné online.
- ↑ Raimund Miller, Claudio Abaecherli, Adel Said, Barry Jackson "Ketenes" in Ullmann's Encyclopedia of Industrial Chemistry, 2001, Wiley-VCH, Weinheim. doi: 10.1002/14356007.a15_063
- ↑ Werner J. Auhorn "Paper and Board, 3. Chemical Additives" in Ullmann's Encyclopedia of Industrial Chemistry Wiley-VCH, Weinheim. 2012. doi:10.1002/14356007.o18_o11
- ↑ Jerome M. Gess; Dominic S. Rend. Alkenyl succinic anhydride (ASA). TAPPI Journal. 2005, s. 25–30. Dostupné online.
- ↑ Edgar Wedekind. Ueber die Gewinnung von Säureanhydriden mit Hülfe von tertiären Aminen. Berichte der Deutschen Chemischen Gesellschaft. 1901, s. 2070–2077. Dostupné online. doi:10.1002/cber.190103402122.
- ↑ Edgar Wedekind. Ueber das Verhalten einiger Säurechloride bei der Chlorwasserstoffentziehung. Justus Liebig's Annalen der Chemie. 1902, s. 246–257. Dostupné online. doi:10.1002/jlac.19023230206.
- ↑ a b Edgar Wedekind; W. Weisswange. Ueber die Synthese eines Diketons der Cyclobutanreihe. Berichte der Deutschen Chemischen Gesellschaft. 1906, s. 1631–1646. Dostupné online. doi:10.1002/cber.19060390287.
- ↑ Edgar Wedekind; J. Häussermann; W. Weisswange; M. Miller. Pyrononsynthesen mit Hilfe der Tertiärbasenreaktion II. Justus Liebig's Annalen der Chemie. 1911, s. 261–292. Dostupné online. doi:10.1002/jlac.19113780302.
- ↑ Hermann Staudinger. Ketene, eine neue Körperklasse. Berichte der Deutschen Chemischen Gesellschaft. 1905, s. 1735–1739. Dostupné online. doi:10.1002/cber.19050380283.
- ↑ H. Staudinger; H. W. Klever. Über Ketene. 5. Mitteilung. Reaktionen des Dimethylketens. Berichte der Deutschen Chemischen Gesellschaft. 1907, s. 1149–1153. Dostupné online. doi:10.1002/cber.19070400117.
- ↑ N. T. M. Wilsomore; A. W. Stewart. Keten. Bemerkungen zu der Abhandlung der HHrn. Staudinger und Klever. Berichte der Deutschen Chemischen Gesellschaft. 1908, s. 1025–1027. Dostupné online. doi:10.1002/cber.190804101202.
- ↑ Rolf Huisgen; Peter Otto. The mechanism of dimerization of dimethylketene. Journal of the American Chemical Society. 1968, s. 5342–5343. doi:10.1021/ja01021a090.
- ↑ DIMETHYLKETENE β-LACTONE DIMER. Org. Synth.. doi:10.15227/orgsyn.048.0072.
- ↑ a b Ketoethenones and process therefor. Původce vynálezu: Sauer John CARL. US. Patentový spis US2369919A. 1945-02-20. Dostupné: <online> [cit. 2024-09-24].
- ↑ J. C. Sauer. Ketene Dimers from Acid Halides. Journal of the American Chemical Society. 1947, s. 2444–2448. doi:10.1021/ja01202a058.
- ↑ Zhiguo Zhang; Guoneng Li; Guilin Hu; Yaoyu Sun. Theoretical Research on the Mechanism of the Dimerization Reactions of Alkyl Ketene. Journal of Chemistry. 2013, s. 1–5. doi:10.1155/2013/481586.
- ↑ Preparation of alkyl ketene dimers. Původce vynálezu: David A. GERSTENHABER. US. Patentový spis US7960497B2. 2011-06-14. Dostupné: <online> [cit. 2024-09-24]. (anglicky)
- ↑ Long-chain ketene dimers. Původce vynálezu: Nils BROLUND. US. Patentový spis US5344943A. 1994-09-06. Dostupné: <online> [cit. 2024-09-24].
- ↑ a b Method for producing alkyl ketene dimers. Původci vynálezu: Roland ETTL, Manfred WINTER, Torsten FREUND. EP. Patentový spis EP1453821A1. 2004-09-08. Dostupné: <online> [cit. 2024-09-24]. (anglicky)
- ↑ Higher alkyl ketene dimer emulsion. Původce vynálezu: William F. DOWNEY. US. Patentový spis US2627477A. 1953-02-03. Dostupné: <online> [cit. 2024-09-24].
- ↑ Aqueous alkylketene dimer dispersions. Původci vynálezu: Christoph HAMERS, Andreas BROCKMEYER, Markus SCHMID. US. Patentový spis US8097124B2. 2012-01-17. Dostupné: <online> [cit. 2024-09-24]. (anglicky)
- ↑ a b c T. Lindström; T. Larsson. A note on AKD-sizing: an investigation of real and apparent contradictions in literature regarding spreadin/diffusion of AKD on cellulose, Report no. 81. [s.l.]: [s.n.], 2005. Dostupné online.
- ↑ J. Lindfors; J. Sahmi; J. Laine; P. Stenius. AKD and ASA model surfaces: preparation and characterization. BioResources. 2007, s. 652–670. Dostupné online.
Literatura
Média použitá na této stránce
Autor: ChemDoc 2010, Licence: CC BY-SA 4.0
Formation of dimethylketendimer
Autor: Smokefoot, Licence: CC BY-SA 4.0
Chemical structure of AKD, without specifying stereochemistry.
Hydrolysis of alkylketene dimers (AKD)
Autor: ChemDoc 2010, Licence: CC BY-SA 4.0
Reaction of AKD with cellulose
Autor: ChemDoc 2010, Licence: CC BY-SA 4.0
Synthesis of alkylketene dimers (AKD)
Autor: ChemDoc 2010, Licence: CC BY-SA 4.0
Structural formula of C18-alkenylsuccinic acid anhydride
Autor: ChemDoc 2010, Licence: CC BY-SA 4.0
Alternative dimerization products from ketenes
Autor: ChemDoc 2010, Licence: CC BY-SA 4.0
Dimerization of dimethylketene








