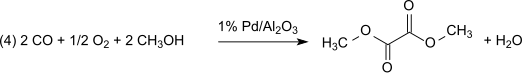Dimethyl-oxalát
| Dimethyl-oxalát | |
|---|---|
 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | dimethyl-oxalát |
| Funkční vzorec | CH3OC(=O)C(=O)OCH3 |
| Sumární vzorec | C4H6O4 |
| Vzhled | bezbarvá pevná látka[1] |
| Identifikace | |
| Registrační číslo CAS | 553-90-2 |
| EC-no (EINECS/ELINCS/NLP) | 209-053-6 |
| PubChem | 11120 |
| SMILES | O=C(OC)C(=O)OC |
| InChI | InChI=1S/C4H6O4/c1-7-3(5)4(6)8-2/h1-2H3 |
| Vlastnosti | |
| Molární hmotnost | 118,09 g/mol |
| Tlak páry | 152 Pa[1] |
| Bezpečnost | |
| [1] | |
| H-věty | H302 H314 H315 H318 H319[1] |
| P-věty | P260 P264+265 P270 P280 P301+317 P301+330+331 P302+352 P302+361+354 P304+340 P305+351+338 P305+354+338 P316 P317 P321 P330 P332+317 P337+317 P362+364 P363 P405 P501[1] |
Některá data mohou pocházet z datové položky. | |
Dimethyl-oxalát je organická sloučenina se vzorcem (CO2CH3)2, dimethylester kyseliny šťavelové; jedná se o bezbarvou pevnou látku rozpustnou ve vodě.
Výroba
Dimethyloxalát lze získat esterifikací kyseliny šťavelové methanolem za katalýzy kyselinou sírovou:[2]
Oxidační karbonylace
Při oxidační karbonylaci postačují k výrobě dimethyloxalátu jednouhlíkaté výchozí látky:[3]
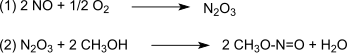
Reakci katalyzuje Pd2+.[4][5][6][7][8] Syntézní plyn se obvykle získává z uhlí nebo biomasy. V průběhu oxidace se vytváří reakcí oxidu dusnatého a kyslíku oxid dusitý (1), který následně reaguje s methanolem (2) za tvorby methylnitritu:[9]
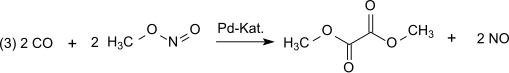
Následuje dikarbonylace methylnitritu oxidem uhelnatým (3) katalyzovaná palladiem, kterou vzniká za atmosférického tlaku a teploty 80-120 °C plynný dimethyloxalát:
Souhrnná rovnice vypadá takto:
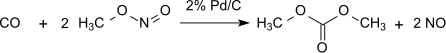
Při tomto postupu nedochází ke ztrátám methylnitritu, který slouží jako nosič oxidačního činidla; je ovšem třeba odstraňovat vznikající vodu, aby nedocházelo k hydrolýze produktu. Při použití 1 % Pd/α-Al2O3 se vytváří dimethyloxalát dikarbonylací, za stejných podmínek s 2 % Pd/C dochází k monokarbonylaci:
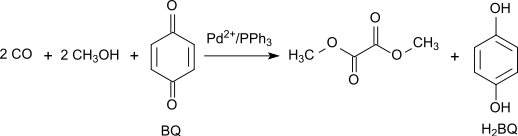
Lze také použít oxidační karbonylaci methanolu 1,4-benzochinonem za katalýzy octanem palladnatým a trifenylfosfinem, ta se vyznačuje vysokými hodnotami výtěžnosti i selektivity. Vhodný poměr octanu, fosfinu a benzochinonu činí 1:3:100, teplota 65 °C a tlak oxidu uhelnatého 7 MPa:[8]
Reakce
Dimethyloxalát se, stejně jako odpovídající diethylester, používá v řadě různých kondenzačních reakcí,[10] například s cyklohexanonem vytváří diketoester, ze kterého lze získat kyselinu pimelovou.[11] Reakcemi diesterů kyseliny šťavelové s diaminy vznikají cyklické diamidy. Kondenzací dimethyloxalátu a o-fenylendiaminu se utváří chinoxalindion:
- C2O2(OMe)2 + C6H4(NH2)2 → C6H4(NHCO)2 + 2 MeOH
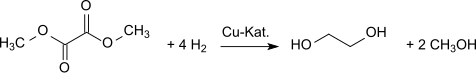
Hydrogenací se dimethyloxalát mění na ethylenglykol.[12] Tuto přeměnu lze provést s 94,7% výtěžností.[13][14][15]
Vzniklý methanol se zapojuje do oxidační karbonylace.[16]
Dekarbonylací se z dimethyloxalátu stává dimethylkarbonát.[17]
Transesterifikační reakcí s fenolem za přítomnosti sloučenin titanu se vyrábí difenyloxalát,[18][19][20] který se, v kapalné nebo plynné fázi, dekarbonyluje na difenylkarbonát.
Dimethyloxalát lze použít také jako methylační činidlo. Vyznačuje se nižší toxicitou, než další methylační činidla, jako jsou jodmethan a dimethylsulfát.[10]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Dimethyl oxalate na anglické Wikipedii.
- ↑ a b c d e https://pubchem.ncbi.nlm.nih.gov/compound/11120
- ↑ Everett Bowden. Methyl Oxalate. Organic Syntheses. 1930, s. 78. doi:10.15227/orgsyn.010.0078.
- ↑ Hans-Jürgen Arpe: Industrielle Organische Chemie: Bedeutende Vor- und Zwischenprodukte, S. 168; ISBN 978-3-527-31540-6
- ↑ US4467109A Process for continuous preparation of diester of oxalic acid. worldwide.espacenet.com [online]. [cit. 2023-12-24]. Dostupné online.
- ↑ EP0108359A1 Process for the preparation of a diester of oxalic acid.. worldwide.espacenet.com [online]. [cit. 2023-12-24]. Dostupné online.
- ↑ EP0425197A2 Process for preparing diester of carbonic acid.. worldwide.espacenet.com [online]. [cit. 2023-12-24]. Dostupné online.
- ↑ US4451666A Synthesis of oxalate esters by the oxidative carbonylation of alcohols with a heterogeneous manganese promoted Pd-V-P catalyst. worldwide.espacenet.com [online]. [cit. 2023-12-24]. Dostupné online.
- ↑ a b E. Amadio: Oxidative Carbonylation of Alkanols Catalyzed by Pd(II)-Phosphine Complexes, PhD Thesis, Ca’Foscari University Venice, 2009
- ↑ X.-Z. Jiang, Palladium Supported Catalysts in CO + RONO Reactions, Platinum Metals Rev., 1990, 34, (4), 178–180
- ↑ a b Jan Bergman; Per-Ola Norrby; Peter Sand. Alkylation with Oxalic Esters. Scope and mechanism. Tetrahedron. 1990, s. 6113–6124. doi:10.1016/S0040-4020(01)87933-3.
- ↑ H. R. Snyder; L. A. Brooks; S. H. Shapiro; A. Müller. Pimelic Acid. Organic Syntheses. 1931, s. 42. doi:10.15227/orgsyn.011.0042.
- ↑ Coal to MEG, Changing the Rules of the Game [online]. [cit. 2016-08-08]. Dostupné v archivu pořízeném z originálu dne 2011-07-14.
- ↑ Process for continuously preparing ethylene glycol. Původci vynálezu: Susumu TAHARA, Kozo FUJII, Keig NISHIHIRA. US. Patentový spis US4453026A. 1984-06-05. Dostupné: <online> [cit. 2023-12-24].
- ↑ TEUNISSEN, Herman T.; ELSEVIER, Cornelis J. Ruthenium catalysed hydrogenation of dimethyl oxalate to ethylene glycol. Chemical Communications. 1997, čís. 7, s. 667–668. Dostupné online [cit. 2023-12-24]. doi:10.1039/a700862g.
- ↑ S. Zhang et al., Highly-Dispersed Copper-Based Catalysts from Cu–Zn–Al Layered Double Hydroxide Precursor for Gas-Phase Hydrogenation of Dimethyl Oxalate to Ethylene Glycol, Catalysis Letters, Sept. 2012, 142 (9), 1121–1127, DOI:10.1007/s10562-012-0871-8
- ↑ Individual news [online]. Dostupné online.
- ↑ US4544507A Production of carbonate diesters from oxalate diesters. worldwide.espacenet.com [online]. [cit. 2023-12-24]. Dostupné online.
- ↑ US5834614A Method for producing a fluorine-containing silicone compound. worldwide.espacenet.com [online]. [cit. 2023-12-24]. Dostupné online.
- ↑ Process for producing diaryl carbonates. Původci vynálezu: Zhen Wei HUANG, Chih Wei CHANG, Chia Jung TSAI. US. Patentový spis US8212066B2. 2012-07-03. Dostupné: <online> [cit. 2024-09-25]. (anglicky)
- ↑ MA, Xinbin; GUO, Hongli; WANG, Shengping. Transesterification of dimethyl oxalate with phenol over TS-1 catalyst. Fuel Processing Technology. 2003-09-15, roč. 83, čís. Advances in C1 Chemistry in the Year 2002, s. 275–286. Dostupné online [cit. 2024-09-25]. ISSN 0378-3820. doi:10.1016/S0378-3820(03)00075-4.
Externí odkazy
 Obrázky, zvuky či videa k tématu Dimethyl-oxalát na Wikimedia Commons
Obrázky, zvuky či videa k tématu Dimethyl-oxalát na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Autor: Cornshovel, Licence: CC BY-SA 4.0
Example methylation of phenol with dimethyl oxalate
Autor: ChemDoc 2010, Licence: CC BY-SA 3.0
Dimethylcarbonat (DMC) aus Dimethyloxalat (DMO)
Autor: ChemDoc 2010, Licence: CC BY-SA 3.0
Ethylenglycol (MEG) aus Dimethyloxalat (DMO)
Autor: ChemDoc 2010, Licence: CC BY-SA 3.0
Monocarbonylierung von Methanol über Methylnitrit zu Dimethylcarbonat
Dimethyl oxalate, structural formula
Autor: Jynto (talk), Licence: CC0
Ball-and-stick model of the dimethyl oxalate molecule, the ester of oxalic acid and methanol.
Colour code:
- Carbon, C: black
- Hydrogen, H: white
- Oxygen, O: red
Autor: ChemDoc 2010, Licence: CC BY-SA 3.0
Oxidative Carbonylierung von Methanol mit Benzochninon als Oxidationsmittel_korrigiert
Autor: ChemDoc 2010, Licence: CC BY-SA 3.0
Synthese von Dimethyloxalat durch oxidative Carbonylierung von Methanol
Autor: ChemDoc 2010, Licence: CC BY-SA 3.0
Synthese von Dimethyloxalat - Summarische Reaktionsgleichung
Autor: ChemDoc 2010, Licence: CC BY-SA 3.0
Synthese von Methylnitrit über NO