Dimethylformamid
| Dimethylformamid | |
|---|---|
 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | N,N-dimethylmethanamid |
| Funkční vzorec | CHON(CH3)2 |
| Sumární vzorec | C3H7NO |
| Vzhled | bezbarvá kapalina[1] |
| Identifikace | |
| Registrační číslo CAS | 68-12-2 |
| EC-no (EINECS/ELINCS/NLP) | 200-679-5 |
| PubChem | 6228 |
| ChEBI | 17741 |
| SMILES | CN(C)C=O |
| InChI | 1S/C3H7NO/c1-4(2)3-5/h3H,1-2H3 |
| Číslo RTECS | LQ2100000 |
| Vlastnosti | |
| Molární hmotnost | 73,094 g/mol |
| Teplota tání | −60 °C (213 K)[1] |
| Teplota varu | 153 °C (426 K)[1] |
| Hustota | 0,94454 g/cm3[1] |
| Viskozita | 0,92 mPa.s (20 °C) |
| Index lomu | 1,4305 (20 °C) |
| Disociační konstanta pKa | −0,3 (konjugovaná kyselina) |
| Rozpustnost ve vodě | mísitelný[1] |
| Rozpustnost v polárních rozpouštědlech | rozpustný v acetonu a ethanolu[1] |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v benzenu a diethyletheru[1] |
| Tlak páry | 0,49 kPa[1] |
| Povrchové napětí | 36,42 mN/m[1] |
| Struktura | |
| Dipólový moment | 3,86 D |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −239,4±1,2 kJ/mol |
| Standardní molární spalná entalpie ΔH°sp | −1941,6±1,2 kJ/mol |
| Měrné teplo | 146,05& J/(K.mol) |
| Bezpečnost | |
| [1] | |
| H-věty | H312 H319 H332 H360D[1] |
| P-věty | P203 P261 P264+265 P271 P280 P302+352 P304+340 P305+351+338 P317 P318 P321 P337+317 P362+364 P405 P501[1] |
| Teplota vzplanutí | 58 °C (331 K)[1] |
| Teplota vznícení | 440 °C (713 K)[1] |
Některá data mohou pocházet z datové položky. | |
Dimethylformamid (zkráceně DMF) je organická sloučenina se vzorcem (CH3)2NC(O)H. Jedná se o bezbarvou kapalinu mísitelnou s vodou, používanou jako rozpouštědlo. Čistý dimethylformamid je bez zápachu, ale znečištěné vzorky zapáchají v důsledku přítomnosti příměsí dimethylaminu. Látka je strukturou podobná formamidu, ve kterém jsou dva amidové vodíky nahrazeny methylovými skupinami. Dimethylformamid je polární aprotické rozpouštědlo s vysokou teplotou varu, vhodné pro reakce s polárními mechanismy, jako jsou například SN2 reakce.
Struktura a fyzikální vlastnosti
Podobně jako většina jiných amidů se u DMF vazby C-N a C-O chovají částečně jako dvojné. V infračervené spektroskopii se objevuje absorpce způsobená prodlužováním vazeb C=O na 1675 cm−1, zatímco u ketonu by byla blízko 1700 cm−1.[2]
Ve spektru protonové nukleární magnetické rezonance se za pokojové teploty objevují dva methylové signály, což naznačuje znemožnění rotace kolem vazby (O)C-N.[2] Při teplotách okolo 100 °C je v 500MHz NMR spektru DMF pouze jeden signál methylových skupin.[3]

DMF je mísitelný s vodou.[4] Jeho tlak páry při 20 °C činí 0,35 kPa.[5] Konstanta Henryho zákona má hodnotu 7.47 × 10−3 Pa m3 mol−1.[6] Rozdělovací koeficient log POW je −0,85.[7]

Reakce
DMF může být obzvláště za vyšších teplot, hydrolyzován silnými kyselinami a zásadami; za přítomnosti hydroxidu sodného se mění na mravenčanový anion a dimethylamin. DMF se za teplot blízko své teploty varu dekarbonyluje na dimethylamin; destilace se tak provádí za sníženého tlaku a nižších teplot.[8]
Dimethylformamid má využití v organické syntéze ve Vilsmeierových–Haackových reakcích, používaných k formylování aromatických sloučenin.[9][10] Na začátku se DMF přeměňuje na chloriminiový ion, [(CH3)2N=CH(Cl)]+, označovaný jako Vilsmeierovo činidlo,[11] který následně reaguje s areny.
Organolithná a Grignardova činidla vytváří reakcemi s DMF a následnou hydrolýzou aldehydy; tento proces se nazývá Bouveaultova syntéza aldehydů.[12]
Dimethylformamid tvoří 1:1 adukty s Lewisovými kyselinami, jako jsou jod a fenol. Patří mezi tvrdé Lewisovy zásady a jeho parametry v ECW modelu jsou EB= 2,19 a CB= 1,31.[13]
Výroba
DMF poprvé připravil francouzský chemik Albert Verley v roce 1893 destilací směsi dimethylaminhydrochloridu a mravenčanu draselného.[14]
Dimethylformamid lze také získat reakcí methylformiátu s dimethylamin em nebo dimethylaminu s oxidem uhelnatým.[15]
Další možností, i když nevýhodnou, je příprava ze superkritického oxidu uhličitého pomocí rutheniových katalyzátorů.[16]
Použití
Dimethylformamid má hlavní využití jako málo se odpařující rozpouštědlo. Používá se při výrobě plastů a akrylátových vláken. Také slouží jako rozpouštědlo v syntéze peptidů v rámci výroby léčiv, ve výrobě pesticidů a lepidel.[4]
- DMF je reaktantem v Bouveaultově syntéze aldehydů[17][18][19] a Vilsmeierových–Haackových reakcích.[9][10].
- DMF je častým rozpouštědlem v Heckových reakcích.[20]
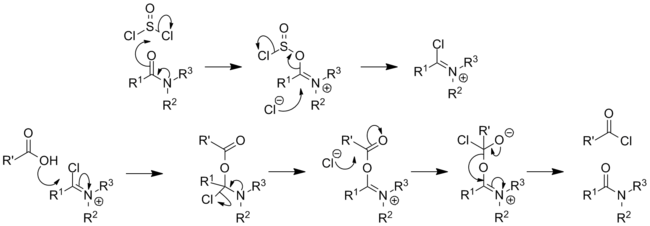
- DMF se také využívá jako katalyzátor přípravy acylhalogenidů, převážně acylchloridů, z karboxylových kyselin s využitím oxalyl- nebo thionylchloridu. Při katalýze dochází k vratné tvorbě imidoylchloridu:[21][22]
- DMF proniká skrz většinu plastů; z tohoto důvodu je vhodný pro syntézu peptidů v pevné fázi a jako přísada do odstraňovačů barev.
- DMF se jako rozpouštědlo používá k odstraňování alkenů, napříkladbuta-1,3-dienu, extrakční destilací.
- Používá se také při výrobě barev; v průběhu reakce se spotřebovává.
- Čistý acetylen nelze stlačit a skladovat bez nebezpečí výbuchu. Průmyslový acetylen se bezpečně stlačuje za přítomnosti dimethylformamidu, který vytváří koncentrovaný roztok.
Jako reaktant má dimethylformamid řadu laboratorních využití.
- DMF účině odstraňuje a suspenduje uhlíkové nanotrubice a dá se použít při jejich zkoumání blízkou infračervenou spektroskopií.[23]
- DMF může sloužit jako standard v protonové NMR pro kvantitativní určení neznámé sloučeniny.
- V organokovové chemii se používá jako zdroj karbonylových ligandů.
- DMF-d7 za přítomnosti katalytického množství KOt-Bu a působení mikrovlnného záření deuteruje polyaromatické uhlovodíky.
Bezpečnost
Reakce, při kterých se používá hydrid sodný v DMF, jsou nebezpečné;[24] i za teploty 26 °C dochází k exotermnímu rozkladu. V laboratořích lze jakémukoliv přílišnému nárůstu teploty zamezit v ledové lázni; na průmyslové úrovni se ale odehrálo několik nehod.[25]
Vystavení parám dimethylformamidu snižuje toleranci k alkoholu a způsobuje podráždění kůže.[26]
Toxicita
Akutní LD50 (při ústním podání u krys a myší) je 2,2–7,55 g/kg.[4][27]
Odkazy
Externí odkazy
 Obrázky, zvuky či videa k tématu dimethylformamid na Wikimedia Commons
Obrázky, zvuky či videa k tématu dimethylformamid na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku Dimethylformamide na anglické Wikipedii.
- ↑ a b c d e f g h i j k l m n https://pubchem.ncbi.nlm.nih.gov/compound/6228
- ↑ a b Dimethylformamide [online]. AIST [cit. 2012-06-28]. Dostupné online. (anglicky)
- ↑ H. S. Gutowsky; C. H. HOLM. Rate Processes and Nuclear Magnetic Resonance Spectra. II. Hindered Internal Rotation of Amides. The Journal of Chemical Physics. 1956, s. 1228–1234. DOI 10.1063/1.1743184. Bibcode 1956JChPh..25.1228G. (anglicky)
- ↑ a b c BIPP, Hansjörg; KIECZKA, Heinz. Formamides. Příprava vydání Wiley-VCH Verlag GmbH & Co. KGaA. Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA Dostupné online. ISBN 978-3-527-30673-2. DOI 10.1002/14356007.a12_001.pub2. (anglicky) DOI: 10.1002/14356007.a12_001.pub2.
- ↑ IPCS (International Programme on Chemical Safety) (1991). Environmental Health Criteria 114 “Dimethylformamide” United Nations Environment Programme, International Labour Organisation, World Health Organization; 1–124
- ↑ Taft, R. W.; ABRAHAM, M. H.; DOHERTY, R. M.; KAMLET, M. J. The molecular properties governing solubilities of organic nonelectrolytes in water. Nature. 1985, s. 384–386. DOI 10.1038/313384a0. Bibcode 1985Natur.313..384T. (anglicky)
- ↑ (BASF AG, department of analytical, unpublished data, J-No. 124659/08, 27.11. 1987)
- ↑ COMINS, Daniel L.; JOSEPH, Sajan P. Encyclopedia of Reagents for Organic Synthesis. N,N-Dimethylformamide. [s.l.]: John Wiley & Sons, 2001. ISBN 9780470842898. DOI 10.1002/047084289x.rd335. Kapitola N,N-Dimethylformamide. (anglicky)
- ↑ a b VILSMEIER, Anton; HAACK, Albrecht. Über die Einwirkung von Halogenphosphor auf Alkyl-formanilide. Eine neue Methode zur Darstellung sekundärer und tertiärer p-Alkylamino-benzaldehyde. Berichte der Deutschen Chemischen Gesellschaft A/B. 1927, s. 119–122. DOI 10.1002/cber.19270600118. (anglicky)
- ↑ a b METH-COHN, Otto; STANFORTH, Stephen P. Additions to CX π-Bonds, Part 2. Redakce Barry M. Trost. [s.l.]: Elsevier, 1993. (Comprehensive Organic Synthesis: Selectivity, Strategy and Efficiency in Modern Organic Chemistry; sv. 2). ISBN 9780080405933. DOI 10.1016/B978-0-08-052349-1.00049-4. Kapitola The Vilsmeier-Haack Reaction, s. 777–794. (anglicky)
- ↑ JONES, Gurnos; STANFORTH, Stephen P. The Vilsmeier Reaction of Non-Aromatic Compounds. Organic Reactions. 2000, s. 355–686. DOI 10.1002/0471264180.or056.02. (anglicky)
- ↑ WANG, Zerong. Comprehensive organic name reactions and reagents. [s.l.]: John Wiley, 2009. ISBN 9780471704508. S. 490–492. (anglicky)
- ↑ Vogel G. C.; DRAGO, R. S. The ECW Model. Journal of Chemical Education. 1996, s. 701–707. DOI 10.1021/ed073p701. Bibcode 1996JChEd..73..701V. (anglicky)
- ↑ VERLEY, A. Sur la préparation des amides en général. Bulletin de la Société Chimique de Paris. 1893, s. 690–692. Dostupné online. (anglicky)
- ↑ Weissermel, K.; ARPE, H.-J. Industrial Organic Chemistry: Important Raw Materials and Intermediates. [s.l.]: Wiley-VCH, 2003. ISBN 3-527-30578-5. S. 45–46. (anglicky)
- ↑ Walter Leitner; PHILIP G. JESSOP. Chemical synthesis using supercritical fluids. [s.l.]: Wiley-VCH, 1999. ISBN 978-3-527-29605-7. S. 408. (anglicky)
- ↑ Louis Bouveault. Modes de formation et de préparation des aldéhydes saturées de la série grasse. Bulletin de la Société Chimique de Paris. 1904, s. 1306–1322. Dostupné online. (anglicky)
- ↑ Louis Bouveault. Nouvelle méthode générale synthétique de préparation des aldéhydes. Bulletin de la Société Chimique de Paris. 1904, s. 1322–1327. Dostupné online. (anglicky)
- ↑ LI, Jie Jack. Name Reactions: A Collection of Detailed Mechanisms and Synthetic Applications. 5th. vyd. [s.l.]: Springer Science & Business Media, 2014. ISBN 978-3-319-03979-4. Kapitola Bouveault aldehyde synthesis, s. 72–73. (anglicky)
- ↑ The Mizoroki–Heck Reaction. Redakce Oestreich Martin. [s.l.]: John Wiley & Sons, 2009. ISBN 9780470716069. (anglicky)
- ↑ Clayden, J. Organic Chemistry. Oxford: Oxford University Press, 2001. Dostupné online. ISBN 0-19-850346-6. S. 276–296. (anglicky)
- ↑ Ansell, M. F. "The Chemistry of Acyl Halides"; S. Patai, Ed.; John Wiley and Sons: London, 1972; pp 35–68
- ↑ Haddon, R.; ITKIS, M. Publication 960-19 Measurement Issues in Single Wall Carbon Nanotubes. Redakce Freiman, S.. [s.l.]: NIST, March 2008. Kapitola 3. Near-Infrared (NIR) Spectroscopy, s. 20. (anglicky)
- ↑ Explosion Hazards of Sodium Hydride in Dimethyl Sulfoxide, N,N-Dimethylformamide, and N,N-Dimethylacetamide Qiang Yang, Min Sheng, James J. Henkelis, Siyu Tu, Eric Wiensch, Honglu Zhang, Yiqun Zhang, Craig Tucker, and David E. Ejeh Organic Process Research & Development 2019 23 (10), 2210-2217 DOI: 10.1021/acs.oprd.9b00276 https://pubs.acs.org/doi/10.1021/acs.oprd.9b00276
- ↑ UK Chemical Reaction Hazards Forum. www.crhf.org.uk [online]. [cit. 2023-06-25]. Dostupné v archivu pořízeném z originálu dne 2011-10-06.
- ↑ LYLE, W. H.; SPENCE, T. W.; MCKINNELEY, W. M.; DUCKERS, K. Dimethylformamide and alcohol intolerance. British Journal of Industrial Medicine. 1979, s. 63–66. DOI 10.1136/oem.36.1.63. PMID 444443. (anglicky)
- ↑ Redlich, C.; BECKETT, W. S.; SPARER, J.; BARWICK, K. W.; RIELY, C. A.; MILLER, H.; SIGAL, S. L. Liver disease associated with occupational exposure to the solvent dimethylformamide. Annals of Internal Medicine. 1988, s. 680–686. DOI 10.7326/0003-4819-108-5-680. PMID 3358569. (anglicky)
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.
Autor: Sbrools, Licence: CC BY-SA 3.0
Dimethylformamide. Created in Inkscape.
Ball-and-stick model of the dimethylformamide molecule, C3H7NO.
Image generated in Accelrys DS Visualizer.Autor: Project Osprey, Licence: CC BY-SA 4.0
Conversion of a carboxylic acid to an acyl chloride using SOCl2 with catalytic DMF
structure of DMF








