Disilen
| Disilen | |
|---|---|
 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | disilen |
| Funkční vzorec | H2Si=SiH2 |
| Sumární vzorec | Si2H4 |
| Vzhled | bílé krystaly[1] |
| Identifikace | |
| Registrační číslo CAS | 106-93-4 |
| EC-no (EINECS/ELINCS/NLP) | 203-444-5 |
| PubChem | 139934 |
| SMILES | C(CBr)Br |
| InChI | 1S/C2H4Br2/c3-1-2-4/h1-2H2 |
| Vlastnosti | |
| Molární hmotnost | 60,203 g/mol |
Některá data mohou pocházet z datové položky. | |
Disilen je anorganická sloučenina se vzorcem Si2H4. Jedná se o nejjednodušší silen.
Struktura
Molekula disilenu obsahuje jednu vazbu Si=Si a čtyři rovnocenné vazby Si-H.
Na rozdíl od ethenu, jehož je analogem, je disilen kineticky nestálý a náchylný k tautomerizaci. Má další dva tautomery, s velmi podobnými energiemi: (μ2-H)disilen a disilanyliden.[2]
Organodisileny

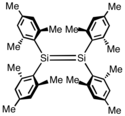
Disileny se stericky zatíženými substituenty mohou být izolovány a jejich vlastnosti jsou podrobně prozkoumány, přestože jde hlavně o předmět akademického zájmu. Prvním stabilizovaným disilenem byl tetramesityldisilen, (C6Me3H2)4Si2. Vazba Si=Si v této molekule má délku 215 pm, přibližně o 10 % menší, než je běžné u jednoduchých vazeb Si–Si. Si2C4 jádra jsou zhruba rovinná.[3] Organodisileny se většinou připravují redukcemi organokřemíkových halogenidů:
- 2 R2SiCl2 + 4 Na → R2Si=SiR2 + 4 NaCl
Další způsob představuje fotolýza trisilacyklopropanů. Pokud substituent nevytváří výraznější sterické efekty, tak jsou produkty, cyklické nebo polymerní, polysilany.
V jedné studii[4] byl získán disilen vnitromolekulární reakcí 1,1-dibromsilanu s grafitem draselným. Dvojná vazba mezi atomy křemíku u vytvořené sloučeniny měla, jak bylo zjištěno rentgenovou krystalografií, délku 227 pm, druhou největší, jež byla kdy zjištěna.
Substituenty okolo vazby Si-Si byly posunuty o 43°. Disilen bylo možné převést na tetracyklickou sloučeninu zahřátím na 110 °C v xylenu.
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Disilene na anglické Wikipedii.
- ↑ https://pubchem.ncbi.nlm.nih.gov/compound/15337
- ↑ M. C. McCarthy; Z. Yu; L. Sari; H. F. Schaefer; P. Thaddeus. Monobridged Si2H4. The Journal of Chemical Physics. 2006-02-15, s. 074303. DOI 10.1063/1.2168150. PMID 16497032. Bibcode 2006JChPh.124g4303M.
- ↑ GREENWOOD, Norman N.; EARNSHAW, Alan. Chemistry of the Elements. 2. vyd. [s.l.]: Butterworth-Heinemann, 1997. ISBN 978-0-08-037941-8.
- ↑ Fused Tricyclic Disilenes with Highly Strained Si-Si Double Bonds: Addition of a Si-Si Single Bond to a Si-Si Double Bond Ryoji Tanaka, Takeaki Iwamoto, and Mitsuo Kira Angewandte Chemie International Edition volume 45, issue 38 , pages 6371 - 6373 2006 DOI:10.1002/anie.200602214
Související články
- Disilan
- Disilyn
Externí odkazy
 Obrázky, zvuky či videa k tématu disilen na Wikimedia Commons
Obrázky, zvuky či videa k tématu disilen na Wikimedia Commons
Média použitá na této stránce
Ball-and-stick model of the disilene molecule, Si2H4. The structure depicted is the trans-bent isomer (C2hpoint group, 1Ag symmetry), H2Si=SiH2, reported to be the lowest energy isomer of Si2H4. Precise molecular structural parameters are hard to find but the overall connectivity, symmetry and coarse geometry are described in J. Chem. Phys. (2006) 124, 074303 and Chem. Phys. Lett. (2008) 466, 11-15. A rationale for the geometry involving π-σ* orbital mixing is given in Proc. Jpn. Acad. Ser. B Phys. Biol. Sci. (2012) 88, 167-191.
R2Si=SiR2 bond lengths in the CSD are typically around 2.2 Å. See, for example, CIJRAO from Organometallics (1984), 3, 793-800.
Colour code:
- Silicon, Si: green-grey
- Hydrogen, H: white
Structure of disilene