Disperzní síla

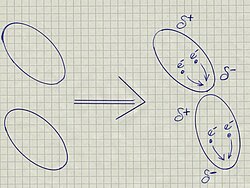
Disperzní síly (neboli Londonovy interakce) jsou elektrostatické síly, které vznikají nejčastěji mezi nepolárními molekulami. Jsou typem mezimolekulárních sil působících mezi molekulami, které mají elektrony symetricky rozloženy mezi atomy. Jsou způsobeny neuspořádaným pohybem elektronů kolem jádra, které se v určitých okamžicích mohou nahromadit k jedné straně molekuly a vzniká tak okamžitý dipól (dočasný dipól, oscilující dipól).
Vektorový součet všech takto vzniklých okamžitých dipólů za delší časový úsek je roven nule. Pokud se k molekule s proměnným dipólem přiblíží jiná molekula, dochází v ní k indukci dalšího dipólu. Tento jev se nazývá Londonův efekt a závisí na polarizovatelnosti molekuly.
Disperzní síly patří mezi tři typy Van der Waalsových sil (Coulombické, indukční a disperzní síly). Jsou z nich nejslabší a zároveň nejvýznamnější.
Disperzní síly byly poprvé analyzovány v roce 1930 Fritzem Wolfgangem Londonem, který ukázal, že jsou důsledkem kvantově mechanických korelací mezi pohybem elektronů ve dvou či více různých atomech nebo molekulách při velkých vzdálenostech.
Disperzní síly jsou základem mnoha vlastností anorganických i organických sloučenin, včetně jejich rozpustnosti v polárních a nepolárních roztocích. Hrají důležitou roli při kohezi (soudržnost), adhezi (přilnavost k povrchům), tření a kondenzaci. Významnou roli hrají také při sbalování a stabilizaci struktur mnoha biopolymerů.
Příčiny a účinky disperzních sil

Polarita vazeb
Příčinou vzniku elektrostatických sil mezi molekulami je polarita chemické vazby mezi atomy, které obsahuje a které mají různou schopnost přitáhnout vazebný elektronový pár.
Polarita chemické vazby je určena rozdílem elektronegativit (∆X) vázaných atomů. Vazebný elektronový pár je vždy více posunut k atomu o větší hodnotě elektronegativity.
Rozdíl elektronegativit atomů v molekule způsobuje u iontových molekul trvalý záporný a kladný náboj (elektronegativita je větší než 1,7), u polárních molekul částečný záporný a kladný náboj (∆X = 0,4–1,7) a u nepolárních molekul vznik okamžitých dipólů (∆X = 0,0–0,4).

Vznik disperzních sil
V nepolárních molekulách jsou nepolární vazby, které mají rozdíl elektronegativity mezi atomy v rozmezí ∆X = 0,0–0,4 a hustota vazebného elektronového páru je tak rozložena mezi dvěma vazebnými atomy téměř stejnoměrně.
I v nepolárních molekulách však dochází díky pohybu elektronů ke vzniku slabých, rychle oscilujících (kmitajících) dipólů. Pokud se k sobě dvě molekuly přiblíží, bude tato oscilace synchronizována tak, že se jejich oscilující dipóly budou přitahovat. Elektrony v sousední molekule jsou polarizovány stejným způsobem. Výsledkem je disperzní síla – přitažlivá síla mezi molekulami s makroskopickými účinky.
Pro atomy a nepolární molekuly je disperzní síla jedinou mezimolekulární silou a je zodpovědná za jejich existenci v kapalném a pevném stavu. Pro polární molekuly je tato síla jednou částí van der Waalsovy síly spolu se silami mezi permanentními molekulárními dipólovými momenty.
Účinky disperzních sil
Disperzní síly jsou prakticky všudypřítomné, protože všechny materiály jsou polarizovatelné. Zatímco Coulombovy a Debyeho síly vyžadují trvalé dipóly, disperzní síly jsou univerzální a působí mezi jakýmikoliv molekulami a atomy – nepolárními, polárními i ionizovanými.
Účinky disperzních sil jsou nejvíce patrné ve sloučeninách, které jsou nepolární (například uhlovodíky) a vysoce symetrické molekuly (například brom Br2 nebo jod I2). V uhlovodících jsou disperzní síly dostatečné k tomu, aby způsobily kondenzaci z plynné fáze do kapalné nebo pevné fáze. U bromu Br2 způsobují jeho kapalinou fázi při pokojové teplotě, u jódu I2 pevnou fázi při pokojové teplotě. Zkapalňování kyslíku O2 a dusíku N2 do kapalných fází dominují také disperzní síly.
Pokud jsou atomy nebo molekuly dané sloučeniny odděleny třetím médiem, je účinek disperzních sil složitější. Ve vodných roztocích jsou účinky disperzních sil mezi atomy nebo molekulami často méně výrazné v důsledku konkurence s polarizovatelnými molekulami vody. Okamžitá fluktuace elektronů je ovlivněna nejen sousedními molekulami téže sloučeniny, ale i rozpouštědlem – vodou.
Velikost a vzdálenost působení
- Disperzní síly jsou úměrné polarizovatelnosti (deformovatelnosti) elektronového obalu atomu či molekuly vnějším elektrickým polem.
- Čím více elektronů molekula má, tím silnější jsou disperzní síly.
- Disperzní síly rostou nepřímo úměrně s šestou mocninou meziatomové vzdálenosti.
- Disperzní síly jsou velmi slabé, neboť se jedná o vzájemné interakce dočasných dipólů. Působí obvykle mezi nepolárními molekulami (například uhlovodíky, F2, O2, N2) nebo mezi atomy (například He, Ar, Ne).
- Energie disperzní síly se obvykle vyjadřuje v kelvinech a dosahuje řádově jednotky kelvinů (jedna kilokalorie na mol odpovídá zhruba čtyřem stům kelvinů).
Ovlivnění vlastností sloučenin
- Disperzní síly vysvětlují existenci kapalných a pevných stavů nepolárních sloučenin, které by neměly existovat, pokud vezmeme v úvahu pouze odpudivou interakci jejich elektronových obalů.
- Body varu a tání u nepolárních sloučenin závisejí na typu a síle přítomných disperzních sil.
- V uhlovodících a voscích jsou disperzní síly dostatečné k tomu, aby způsobily kondenzaci z plynné fáze do kapalné a následně do pevné fáze.
- Sublimační teplo uhlovodíkových krystalů je ovlivněno disperzními silami.
- Zkapalňování kyslíku a dusíku do kapalných fází dominují také disperzní síly.
- Dokonce vysoce symetrické částice (atomy vzácných plynů, molekuly vodíku H2 nebo methanu CH4) při dostatečně nízké teplotě zkondenzují z plynné fáze do kapalné právě vlivem disperzních sil.
Příklady sloučenin
V následující tabulce jsou uvedeny sloučeniny, ve kterých jsou intermolekulární interakce silně ovlivněny disperzními silami. Například v molekule neonu Ne2 jsou tyto síly tvořeny disperzními silami ze 100%, mezi molekulami vody H2O je to pouze 24% (zde převažují vodíkové vazby).
| Pár molekul | % celkové energie interakce |
|---|---|
| Ne-Ne | 100 |
| HCl-HCl | 86 |
| HBr-HBr | 96 |
| HI-HI | 99 |
| CH3Cl-CH3Cl | 68 |
| NH3-NH3 | 57 |
| H2O-H2O | 24 |
| HCl-HI | 96 |
| H2O-CH4 | 87 |
Reference
V tomto článku byly použity překlady textů z článků London-Kraft na německé Wikipedii a London dispersion force na anglické Wikipedii.
Související články
Média použitá na této stránce
Autor: GFHund, Licence: CC BY 3.0
Fritz London, Munich 1928 at the Bunsen congress.
Autor: Riccardo Rovinetti, Licence: CC BY-SA 3.0
Induced-dipoles in iodine. (London dispersion forces).