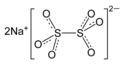
Dithionan sodný
| Dithionan sodný | |
|---|---|
 Molekula | |
 Uspořádání molekuly - kuličkový model | |
| Obecné | |
| Systematický název | Dithionan sodný |
| Anglický název | Sodium dithionate, disodium dithionate, sodium hyposulfate, sodium metabisulfate |
| Sumární vzorec | Na2S2O6 |
| Vzhled | Bílý krystalický prach |
| Identifikace | |
| Registrační číslo CAS | 7631-94-9 |
| Vlastnosti | |
| Molární hmotnost | 206,11 g/mol |
| Teplota tání | 52 °C; tj. 325 K za rozkladu |
| Teplota varu | (rozklad) |
| Hustota | 2,19 g/cm3 |
| Rozpustnost ve vodě | bezvodý: 6,05 g/100 g (0 °C) |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Dithionan sodný je důležitá sloučenina pro anorganickou chemii. jeho vzorec je Na2S2O6, kde jsou centrální atomy síry vázány přímo, bez kyslíkového můstku, přičemž každá síra je ve formálním mocenství VI., vzájemnou vazbou formálně sníženém o 1, tedy na V. Pozor na záměnu s dithioničitanem sodným, který je sloučeninou s velmi odlišnými vlastnostmi (na rozdíl od dithionanu má silné redukční vlastnosti), tato záměna se vyskytuje často, dokonce i v některých katalozích výrobců.
Příprava
Připravuje se oxidací hydrogensiřičitanu sodného oxidem manganičitým[1]:
Případně může být připraven oxidací siřičitanu sodného stříbrným kationtem:
Podobné sloučeniny
- Thiosíran sodný (Na2S2O3)
- Disíran sodný (Na2S2O7)
- Dithioničitan sodný (Na2S2O4)
- Dithiosíran sodný (Na2S3O2)
- Diselenan sodný (Na2Se2O6)
- Tetrathionan sodný (Na2S4O6)
- Dithionan draselný (K2S2O6)
- Dithionan lithný (Li2S2O6)
Reference
V tomto článku byl použit překlad textu z článku Sodium dithionate na anglické Wikipedii.
Média použitá na této stránce
Ball-and-stick model of sodium dithionate (also known as sodium hyposulfate, and sodium metabisulfate), showing two sodium cations and one dithionate anion.
Not to be confused with sodium dithionite.