Dusičnan amonný
| Dusičnan amonný | |
|---|---|
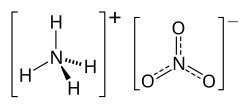 2D model molekuly NH4NO3 | |
 | |
| Obecné | |
| Systematický název | Dusičnan amonný |
| Triviální název | Ledek amonný |
| Ostatní názvy | Amoniumnitrát |
| Anglický název | Ammonium nitrate |
| Německý název | Ammoniumnitrat |
| Sumární vzorec | NH4NO3 |
| Vzhled | bílé krystalky nebo prášek |
| Identifikace | |
| Registrační číslo CAS | 6484-52-2 |
| Číslo RTECS | BR9050000 |
| Vlastnosti | |
| Molární hmotnost | 80,043 g/mol |
| Teplota tání | 169,6 °C |
| Teplota rozkladu | 210 °C |
| Hustota | 1,725 g/cm3 1,66 g/cm3 (170 °C) |
| Index lomu | α-modifikace nDa= 1,45 nDb= 1,59 nDc= 1,63 β-modifikace nD= 1,413 (20 °C) |
| Rozpustnost ve vodě | 117,43 g/100 g (0 °C) 150 g/100 g (10 °C) 189,87 g/100 g (20 °C) 246,25 g/100 g (32 °C) 421 g/100 g (60 °C) 600 g/100 g (80 °C) 871 g/100 g (100 °C) |
| Rozpustnost v polárních rozpouštědlech | methanol 17,1 g/100 ml (20 °C) ethanol 3,80 g/100 ml (20 °C) aceton diethylether (ne) |
| Měrná magnetická susceptibilita | −5,2×10−6 cm3g−1 |
| Struktura | |
| Krystalová struktura | kosočtverečná (α) krychlová (β) tetragonální (γ) |
| Hrana krystalové mřížky | a= 575 pm b= 545 pm c= 496 pm |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −365,1 kJ/mol |
| Entalpie tání ΔHt | 80,0 J/g |
| Entalpie rozpouštění ΔHrozp | 321 J/g |
| Standardní molární entropie S° | 151 JK−1mol−1 |
| Standardní slučovací Gibbsova energie ΔGf° | −183,8 kJ/mol |
| Izobarické měrné teplo cp | 1,737 JK−1g−1 |
| Bezpečnost | |
| [1] Varování[1] | |
| R-věty | R8,R36,R37,R38 |
| S-věty | S15,S16,S26,S36 |
| NFPA 704 | |
Některá data mohou pocházet z datové položky. | |
Dusičnan amonný, triviálním názvem ledek amonný či amoniumnitrát, je chemická sloučenina (dusičnan amoniaku) s chemickým vzorcem NH4NO3. Je to bílá krystalická látka používaná jako zemědělské hnojivo a díky oxidačním vlastnostem také v pyrotechnice.
Bezpečnost
Dusičnan amonný se při opatrném zahřátí bezvýbušně rozkládá na oxid dusný („rajský plyn“) a vodní páru:
- NH4NO3 → N2O + 2 H2O
Jinak se může také při zahřátí nebo jiné iniciaci rozložit prudkou exotermní reakcí
- NH4NO3 → N2 + 1/2 O2 + 2 H2O
s vývojem velkého objemu plynných produktů; tedy dojde k detonaci. Účinek se zesílí přidáním malého množství hořlaviny, odpovídajícího produkovanému kyslíku. Tak vzniká významná průmyslová trhavina, používaná i jako munice (letecké bomby).
Velké zásoby ledku amonného, který je jinak vynikajícím dusíkatým hnojivem, jsou významným požárním rizikem, podporují hoření a mohou snadno vést až právě k detonaci. Výbuchy dusičnanu amonného nejsou vzácným jevem, k méně závažným případům dochází téměř každoročně. Zaznamenáno však bylo i několik rozsáhlých, zničujících výbuchů, k nimž se řadí:
- Exploze 4500 t v Oppau (dnes součást města Ludwigshafen) v Německu 21. září 1921 (561 mrtvých)
- Neštěstí v Texas City (přístav v Mexickém zálivu) v USA 16. dubna 1947 (2300 t, 581 mrtvých)
- Exploze chemičky AZF v Toulouse, Francie 21. září 2001[2]
- Exploze v továrně Adair Grain, West (TX), USA, 17. dubna 2013[3]
- Exploze v Tchien-ťinu (přístav ve Žlutém moři) v Číně 12. srpna 2015
- Výbuch 2750 t v přístavním skladu v Bejrútu (Středozemní moře) v Libanonu 4. srpna 2020 [4] (přes 200 mrtvých, poškozeno obydlí 300 tis. obyvatel)
S ohledem na svou nebezpečnost je dusičnan amonný uveden v seznamu látek považovaných za prekurzory výbušnin, jejichž prodej nepodnikajícím fyzickým osobám podléhá v Evropské unii dozoru, aby bylo zabráněno jejich zneužití k nedovolené výrobě výbušnin.[5] Dusičnan amonný nelze podle tohoto nařízení prodávat ani držet samostatně ani ve směsích či látkách, v nichž je koncentrace dusíku pocházejícího z dusičnanu amonného větší nebo rovna 16 % hmotnosti.
Příprava
Dusičnan amonný může vznikat přeměnou močoviny:
Průmyslově se však vyrábí reakcí kyseliny dusičné a čpavku:[6]
- HNO3 + NH3 → NH4NO3
Dusičnan amonný se také vyrábí amatérskými nadšenci reakcí:
- Ca(NO3)2 + (NH4)2SO4 → 2 NH4NO3 + CaSO4[zdroj?!]
Tato reakce je silně exotermní. Lze ho také připravit reakcí AgNO3(aq) s NH4Cl(aq), přičemž vzniká jako nerozpustná sůl AgCl, která se dá odfiltrovat, takže výtěžek je pak poměrně vysoký.
Využití
- V zemědělství jako hnojivo (práškový[7] nebo ve směsi s močovinou jako vodný roztok, tzv. DAM [8])
- V pyrotechnice
- Složka explosivní náplně některých bomb, např. BLU-82
Reference
- ↑ a b Ammonium nitrate. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ Ve Francii začíná soudní proces století. Česká televize [online]. 23. února 2009. Dostupné online.
- ↑ Příčina výbuchu ledek. Bejrút není první podobný případ. Seznam Zprávy [online]. Seznam.cz, 6. srpna 2020. Dostupné online.
- ↑ Výbuch v Bejrútu: Lidé hledají blízké, na místo míří zahraniční pomoc. Seznam Zprávy [online]. Seznam.cz [cit. 2020-08-05]. Dostupné online.
- ↑ Nařízení Evropského parlamentu a Rady (EU) 2019/1148 ze dne 20. června 2019 o uvádění prekurzorů výbušnin na trh a o jejich používání, změně nařízení (ES) č. 1907/2006 a zrušení nařízení (EU) č. 98/2013. EUR-Lex [online]. [cit. 2020-08-04]. Dostupné online.
- ↑ Process_of_producing_concentrated_soluti
- ↑ Bezpečnostní list jednoho z dodavatelů. fertis.hokr.cz [online]. 2024-09-16 [cit. 2024-10-29]. Dostupné online.
- ↑ Popis produktu jako průmyslového hnojiva od jednoho z dodavatelů. hokr.cz [online]. [cit. 2024-10-29]. Dostupné online.
Literatura
- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu dusičnan amonný na Wikimedia Commons
Obrázky, zvuky či videa k tématu dusičnan amonný na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for oxidizing substances
Dusičnan amonný, NH4NO3
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.







