Dusičnan amonno-ceričitý
| Dusičnan amonno-ceričitý | |
|---|---|
 Vzorek dusičnanu amonno-ceričitého | |
| Obecné | |
| Systematický název | dusičnan amonno-ceričitý |
| Funkční vzorec | (NH4)2[Ce(NO3)6] |
| Sumární vzorec | N8H8CeO18 |
| Vzhled | oranžovočervený prášek[1] |
| Identifikace | |
| Registrační číslo CAS | 16774-21-3 |
| EC-no (EINECS/ELINCS/NLP) | 240-827-6 |
| PubChem | 180504 |
| SMILES | [Ce+4].O=[N+]([O-])[O-].[O-][N+]([O-])=O.[O-][N+]([O-])=O.[O-][N+]([O-])=O.[O-][N+]([O-])=O.[O-][N+]([O-])=O.[NH4+].[NH4+] |
| InChI | 1S/Ce.6NO3.2H3N/c;6*2-1(3)4;;/h;;;;;;;2*1H3/q+4;6*-1;;/p+2 |
| Vlastnosti | |
| Molární hmotnost | 548,22 g/mol |
| Teplota tání | 108 °C (381,0 K) |
| Rozpustnost ve vodě | 141 g/100 ml (25 °C) 227 g/100 ml (80 °C) |
| Bezpečnost | |
| [1] | |
| H-věty | H272 H302 H315 H318 H319 H335[1] |
| P-věty | P210 P220 P261 P264+265 P270 P271 P280 P301+317 P302+352 P304+340 P305+351+338 P305+354+338 P317 P319 P321 P330 P332+317 P337+317 P362+364 P370+378 P403+233 P405 P501[1] |
Některá data mohou pocházet z datové položky. | |
Dusičnan amonno-ceričitý je anorganická sloučenina se vzorcem (NH4)2[Ce(NO3)6]. Používá se jako oxidační činidlo v organické syntéze a jako standard v kvantitativní analýze.
Příprava a vlastnosti
Anion [Ce(NO3)6]2− vzniká rozpouštěním oxidu ceritého (Ce2O3) v horké koncentrované kyselině dusičné (HNO3).
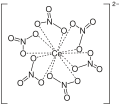
Sůl se skládá z hexanitratoceričitanového aniontu, [Ce(NO3)6]2−, a dvou amonných kationtů, NH +
4 ; amonné ionty se oxidačních reakcí této soli neúčastní. Každá dusičnanová skupina je navázána na atom ceru jako bidentátní ligand:
Strukturní vzorec hexanitrato-
ceričitanového aniontuModel hexanitrato-
ceričitanového aniontu<ref>{{Citace periodika
Anion [Ce(NO3)6]2− vykazuje molekulovou symetrii typu Th. CeO12 jádra mají tvar dvacetistěnu.[2]
Ceričité ionty (Ce4+) jsou silnými oxidačními činidly, jejich redoxní potenciál (E° ~ 1,61 V) je vyšší než u chloru (Cl) (E° ~ 1,36 V) a pouze několik málo stálých látek má silnější oxidační účinky. Při redukci Ce4+ na Ce3+ dochází ke změně barvy roztoku z oranžové na světle žlutou.
Použití
V organické syntéze lze dusičnan amonno-ceričitý použít k oxidacím řady funkčních skupin (alkoholů, fenolů a etherů) a vazeb C–H, obzvláště benzylových. Alkeny bývají dinitroxylovány, přesný výsledek reakce ale závisí na použitém rozpouštědle. Z katecholů a hydrochinonů lze připravit chinony, zoxidovat se dají též nitroalkany.[3][4]
Použití dusičnanu amonno-ceričitého je alternativou Nefovy reakce, například při syntéze ketomakrolidu, kde se v případě použití jiných činidel často objevují vedlejší reakce. Oxidační bromaci benzylových skupin lze provést pomocí dusičnanu amonno-ceričitého jako oxidantu; podobně je možné jodovat ketony a deriváty uracilu.
Příprava heterocyklických sloučenin
Katalytická množství (NH4)2[Ce(NO3)6] ve vodných roztocích mohou být použita na přípravu chinoxalinů. Chinoxaliny se dají použít jako barviva, organické polovodiče, a na štěpení DNA; také jsou součástí struktury některých antibiotik, například echinomycinu a aktinomycinu. Třísložkové reakce anilinů s alkylvinylethery katalyzované touto látkou mohou být použity na tvorbu 2-methyl-1,2,3,4-tetrahydrochinolinů a příslušných chinolinů jejich aromatizací.
Odstraňování chránicích skupin
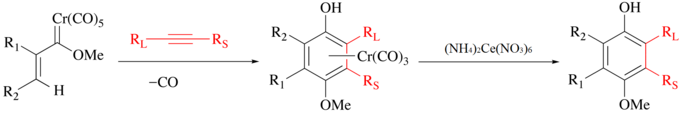
Dusičnan amonno-ceričitý se používá na odstraňování organických ligandů z karbonylových komplexů. Při těchto reakcích dochází k oxidaci kovu a uvolnění CO a organického ligandu, který může být dále použit.[5] Jako příklad může sloužit Wulffova–Dötzova reakce alkynu, oxidu uhelnatého a karbenu chromu za vzniku polosendvičového komplexu[6][7] a izolace fenolového ligandu po oxidaci dusičnanem amonno-ceričitým.
(NH4)2[Ce(NO3)6] může také štěpit para-methoxybenzyl- a 3,4-dimethoxybenzylethery, používané jako chránicí skupiny na alkoholech.[8][9] Na každý ekvivalent para-methoxybenzyletheru jsou třeba dva ekvivalenty (NH4)2[Ce(NO3)6]. Po oddělení alkoholu se para-methoxybenzylether mění na para-methoxybenzaldehyd:
- 2 [NH4]2[Ce(NO3)6] + H3COC6H4CH2OR + H2O → 4 NH +
4 + 2 Ce3+ + 12 NO −
3 + 2 H+ + H3COC6H4CHO + HOR
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Ceric ammonium nitrate na anglické Wikipedii.
- ↑ a b c d https://pubchem.ncbi.nlm.nih.gov/compound/180504
- ↑ Thomas A. Beineke; J. Delgaudio. Crystal structure of ceric ammonium nitrate. Inorganic Chemistry. 1968, s. 715–721. DOI 10.1021/ic50062a020.
- ↑ Vijay Nair; Ani Deepthi. Cerium(IV) Ammonium Nitrate - A Versatile Single-Electron Oxidant. Chemical Reviews. 2007, s. 1862–1891. DOI 10.1021/cr068408n. PMID 17432919.
- ↑ Vellaisamy Sridharan; J. Carlos Menéndez. Cerium(IV) Ammonium Nitrate as a Catalyst in Organic Synthesis. Chemical Reviews. 2010, s. 3805–3849. DOI 10.1021/cr100004p. PMID 20359233.
- ↑ L. Brener, J. S. McKennis, R. Pettit Cyclobutadiene in Synthesis: endo-Tricyclo[4.4.0.02,5]deca-3,8-diene-7,10-dione Organic Syntheses 1976, 55, 43 DOI:10.15227/orgsyn.055.0043
- ↑ M. Waters; W. D. Wulff. The Synthesis of Phenols and Quinones via Fischer Carbene Complexes. Organic Reactions. 2008, s. 121–623. DOI 10.1002/0471264180.or070.02.
- ↑ K. H. Dötz. Carbon-Carbon Bond Formation via Carbonyl-Carbene Complexes. Pure and Applied Chemistry. 1983, s. 1689–1706. DOI 10.1351/pac198355111689.
- ↑ Boons, Geert-Jan.; Hale, Karl J. (2000). Organic Synthesis with Carbohydrates (1st ed.) Sheffield, England: Sheffield Academic Press. pp.33
- ↑ Kocienski, Phillip J. (1994). Protecting Groups Stuttgart, New York Georg Thieme Verlag. pp 8-9, 52-54
Externí odkazy
 Obrázky, zvuky či videa k tématu Dusičnan amonno-ceričitý na Wikimedia Commons
Obrázky, zvuky či videa k tématu Dusičnan amonno-ceričitý na Wikimedia Commons - Dusičnan amonno-ceričitý na organic-chemistry.org
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Dusičnan amonno-ceričitý
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for oxidizing substances
Structure of the hexanitratocerate anion
Ball-and-stick model of the coordination geometry of the [Ce(NO3)6]2− ion in the crystal structure of ceric ammonium nitrate, (NH4)2[Ce(NO3)6]. The structure was determined by X-ray crystallography and reported in Inorg. Chem. (1968) 7, 715-721 (ICSD entry 22219, CSD entry 1598999).
Colour code:
- Cerium, Ce: pale yellow
- Nitrogen, N: blue
- Oxygen, O: red