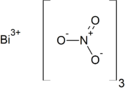Dusičnan bismutitý
| dusičnan bismutitý | |
|---|---|
 | |
 | |
| Obecné | |
| Systematický název | Dusičnan bismutitý |
| Anglický název | Bismuth(III) nitrate |
| Německý název | Bismut(III)-nitrat |
| Sumární vzorec | Bi(NO3)3 |
| Identifikace | |
| Registrační číslo CAS | 10035-06-0 |
| EC-no (EINECS/ELINCS/NLP) | 600-076-0 |
| PubChem | 107711 |
| SMILES | [N+](=O)([O-])[O-].[N+](=O)([O-])[O-].[N+](=O)([O-])[O-].[Bi+3] |
| InChI | InChI=bezvodý: InChI=1S/Bi.3NO3/c;3*2-1(3)4/q+3;3*-1 Key: PPNKDDZCLDMRHS-UHFFFAOYSA-N |
| Vlastnosti | |
| Molární hmotnost | 395,00 g/mol 485.07 g/mol (pentahydrát) |
| Teplota tání | 30 °C |
| Teplota varu | 75 - 80 °C |
| Hustota | 2.90 g/cm3 (pentahydrát) |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H272 H315 H319 H335 H411 |
| P-věty | P210 P220 P221 P261 P264 P271 P273 P280 P302+352 P304+340 P305+351+338 P312 P321 P332+313 P337+313 P362 P370+378 P391 P403+233 P405 P501 |
Některá data mohou pocházet z datové položky. | |
Dusičnan bismutitý je anorganická sůl složená z kationtu bismutu v oxidačním čísle +3 a tří dusičnanových aniontů. Jeho nejběžnější tuhou formou je pentahydrát.[2] Využívá se při syntéze dalších sloučenin bismutu.[3] Je to jediný známý dusičnan prvku 15. skupiny, což ukazuje na kovovou povahu bismutu.[4]
Příprava a reakce
Dusičnan bismutitý lze připravit reakcí bismutu a koncentrované kyseliny dusičné.[5]
Bi + 4 HNO3 → Bi(NO3)3 + 2 H2O + NO
Rozpouští se v kyselině dusičné, ale snadno se hydrolyzuje za vzniku oxidů-dusičnanů, pokud je pH nad 0.[6]
Je také rozpustný v acetonu, kyselině octové a glycerolu, ale prakticky nerozpustný v ethanolu a ethylacetátu.[7]
Používá se k přípravě Dragendorffova činidla.
Dusičnan bismutitý tvoří nerozpustné komplexy s pyrogallolem a kupferronem a tyto sloučeniny byly základem gravimetrických metod stanovení obsahu bismutu.[8]
Při zahřívání se může dusičnan bismutitý rozkládat za vzniku oxidu dusičitého.[9]
Odkazy
Reference
V tomto článku byly použity překlady textů z článků Bismuth(III) nitrate na anglické Wikipedii a Bismut(III)-nitrat na německé Wikipedii.
- ↑ a b Bismuth nitrate. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ "Normal Bismuth Nitrate, Bi(NO3)3". načteno 23.7.2020 (anglicky)
- ↑ Mary Eagleson (1994). Concise encyclopedia chemistry. Walter de Gruyter. ISBN 3110114518.
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-0379418.
- ↑ Rich, Ronald (2007). Inorganic Reactions in Water (e-book). Springer. ISBN 9783540739623.
- ↑ Lazarini, F. (1981). "Thermal dehydration of some basic bismuth nitrates". Thermochimica Acta. 46 (1): 53–55. doi:10.1016/0040-6031(81)85076-9. ISSN 0040-6031.
- ↑ Suzuki, Hitomi, ed. (2001). Organobismuth Chemistry. Elsevier. ISBN 0444205284.
- ↑ A.I. Vogel,(1951), Quantitative Inorganic analysis, (2d edition), Longmans Green and Co
- ↑ Krabbe, S.W.; Mohan, R.S. (2012). "Environmentally friendly organic synthesis using Bi(III) compounds". v Ollevier, Thierry (ed.). Topics in Current chemistry 311, Bismuth-Mediated Organic Reactions. Springer. str. 100–110. ISBN 9783642272394.
Externí odkazy
 Obrázky, zvuky či videa k tématu dusičnan bismutitý na Wikimedia Commons
Obrázky, zvuky či videa k tématu dusičnan bismutitý na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for oxidizing substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Autor: Copiero ergo sum, Licence: CC BY-SA 4.0
Chemický vzorec dusičnanu bismutitého
Dusičnan bismutitý, Bi(NO3)3