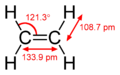Dvojná vazba (chemie)

Dvojná vazba je forma kovalentní vazby, která obsahuje čtyři vazebné elektrony. Tyto elektrony tvoří dva elektronové páry, které pak spojují dva atomy. Dvojné vazby jsou bohaté na elektrony, proto jsou reaktivní. zvláště v přítomnosti silného akceptoru elektronů (například halogenů). Ve strukturních vzorcích se dvojná vazba znázorňuje dvěma rovnoběžnými čarami mezi atomy.[1]
Mezi stejnými dvěma atomy je dvojná vazba obecně silnější a kratší než vazba jednoduchá. Pokud molekula obsahuje dvě nebo více dvojných vazeb, jsou označovány podle polohy jako kumulované, konjugované nebo izolované.
Nejčastější dvojnou vazbou je vazba mezi dvěma atomy uhlíku v alkenech. Existuje ale i mezi dalšími prvky. Například v karbonylové skupině mezi atomem uhlíku a atomem kyslíku (C=O), v azosloučeninách (N=N), iminech (C=N) a sulfoxidech (S=O).
Historie
- Dvojné vazby zavedl v chemické terminologii ruský chemik Alexander Michajlovič Butlerov (1828–1886).
- Reprezentaci dvojné vazby dvěma dvojnými čarami zavedl rakouský chemik a fyzik Johann Josef Loschmidt (1821–1895).
- Koncovky -an, -en, -in pro označení nasycených (jednoduchá vazba) a nenasycených alkanů (dvojná a trojná vazba) zavedl německý chemik August Wilhelm von Hofmann (1818–1892).
Princip dvojné vazby

Princip dvojné vazby se dá jednoduše vysvětlit pomocí hybridizace orbitalů, což je proces energetického sjednocení původně energeticky nerovnocenných atomových orbitalů. Například u atomu uhlíku, který má čtyři valenční elektrony umístěné v orbitalech 2s a 2p, může dojít ke třem typům hybridizace:
- sp2 – dvojná trigonální (trojúhelníková) vazba v alkenech
- sp3 – jednoduchá tetraedrická (trojboký jehlan) vazba v alkanech
Například v ethenu CH2=CH2 má každý atom uhlíku tři hybridizované orbitaly sp2 (leží v jedné rovině s uhly 120° mezi nimi) a jeden nehybridizivaný orbital pz (leží kolmo k této rovině). Když se tyto dva atomy uhlíku přiblíží, jeden ze tří orbitalů sp2 na prvním uhlíku vytvoří σ vazbu s příslušným orbitalem sp2 na druhém uhlíku. Ve stejnou chvíli spolu orbitaly pz obou uhlíků vytvoří π vazbu. Tak mezi nimi vznikne dvojná vazba.
- (c) David Pilz, CC BY-SA 3.0Dva sp2 se přiblíží a vytvoří σ vazbu, která leží v rovině.
- (c) David Pilz, CC BY-SA 3.0Dva pz orbitaly se překryjí a vytvoří π vazbu v rovině rovnoběžné se σ vazbou
Vlastnosti dvojné vazby

Mají-li molekuly s dvojnou vazbou dva různé substituenty, rozlišuje se mezi cis- a trans-izomery podle jejich polohy k dvojné vazbě. Důvodem je maximální překryv orbitalů pz, které jsou kolmé k hybridizovaným orbitalům sp2, a proto není možná rotace kolem dvojné vazby.
Pokud má sloučenina více dvojných vazeb, dělí se podle své polohy na:
- kumulativní vazby – jsou přímo sousedící
- konjugované vazby – jsou oddělené právě jednou jednoduchou vazbou
- izolované vazby – jsou oddělené více než jednou jednoduchou vazbou
Příklady sloučenin

Odkazy
Související články
Reference
V tomto článku byly použity překlady textů z článků Double bond na anglické Wikipedii a Doppelbindung na německé Wikipedii.
- ↑ Organic Chemistry 2nd Ed. John McMurry
Externí odkazy
 Obrázky, zvuky či videa k tématu dvojná vazba na Wikimedia Commons
Obrázky, zvuky či videa k tématu dvojná vazba na Wikimedia Commons
Média použitá na této stránce
Structural formula of the ethylene (ethene) molecule, C2H4. The molecule belongs to the D2h point group.
Structural information (determined by microwave spectroscopy) from CRC Handbook, 88th edition.Structural diagram of the dimethyl sulfoxide molecule
Structural formula of the acetone molecule, Me2CO, C3H6O.
Structural information (determined by gas-phase electron diffraction and microwave spectroscopy) from CRC Handbook, 88th edition.Autor: Grasso Luigi, Licence: CC BY-SA 4.0
Struttura isomero geometrico Trans del diazene N2H2
(c) David Pilz, CC BY-SA 3.0
Es entsteht ein planares Molekül mit einer σ- und einer π-Bindung
Structure of Dimethyl sulfoxide
Autor:
| This file was made by User:Sven | ||
 If this image contains text, it can be translated easily into your language. If you need help, contact me |
If you want to use this picture with another license than stated below, contact me |
 If you need a really fast answer, mail me. If you need only a fast answer, write me here. |
This shows the geometry of a sp2-orbital
Displayed formula of acetone, the simplest ketone. Created for the German "Leuckart-Wallach-Reaktion" article