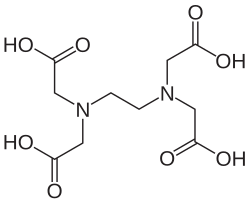
EDTA
| EDTA | |
|---|---|
 | |
| Obecné | |
| Systematický název | 2,2′,2′′,2′′′-(ethan-1,2-diyldinitrilo)tetraoctová kyselina |
| Triviální název | edetová kyselina |
| Ostatní názvy | ethylenndiamintetraoctová kyselina; (ethylendinitrilo)tetraoctová kyselina; N,N′-ethan-1,2-diylbis[N-(karboxymethyl)glycin] |
| Latinský název | acidum edeticum |
| Anglický název | Ethylenediaminetetraacetic acid Edetic acid |
| Sumární vzorec | C₁₀H₁₆N₂O₈ |
| Identifikace | |
| Registrační číslo CAS | 60-00-4 |
| EC-no (EINECS/ELINCS/NLP) | 200-449-4 |
| PubChem | 6049 |
| ChEBI | 42191 |
| UN kód | 3077 |
| SMILES | OC(=O)CN(CC(=O)O)CCN(CC(=O)O)CC(=O)O |
| InChI | InChI=1S/C10H16N2O8/c13-7(14)3-11(4-8(15)16)1-2-12(5-9(17)18)6-10(19)20/h1-6H2,(H,13,14)(H,15,16)(H,17,18)(H,19,20) |
| Číslo RTECS | AH4025000 |
| Vlastnosti | |
| Molární hmotnost | 292,25 g/mol |
| Hustota | 0,860 g/cm3 (20 °C) |
| Disociační konstanta pKa | 2,0 2,7 6,16 10,26 |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −1765,4 až −1758,0 kJ/mol |
| Standardní molární spalná entalpie ΔH°sp | −4461,7 až −4454,5 kJ/mol |
| Bezpečnost | |
| [1] Varování[1] | |
| NFPA 704 | |
Některá data mohou pocházet z datové položky. | |
EDTA je široce užívaná zkratka pro organickou sloučeninu kyselinu ethylendiaminotetraoctovou (z angl. ethylenediaminetetraacetic acid), triviálně kyselinu edetovou (INN), případně její soli (edetáty, INN). EDTA je polyaminokarboxylová kyselina s chemickým vzorcem [CH2N(CH2CO2H)2]2. EDTA je běžně dostupná ve formě kyseliny (Chelaton 2, H4EDTA), která je ve vodě jen málo rozpustná (0,4 g/l[2]), dobře rozpustné (96 g/l[3]) dihydrogensodné soli (chelaton 3, Na2H2EDTA), výborně rozpustné (550 g/l[4]) (tetra)sodné soli (Na4EDTA) a celé řadě solí jiných solí (Mn2+, Zn2+, Fe3+, Cu2+, Ca2+) používaných ve hnojivech (mikronutrienty). Vápenatosodná sůl EDTA (CaNa2.EDTA) se používá také jako potravinářské aditivum E385.
Využití

EDTA patří mezi chelatační činidla, což v praxi znamená, že je schopná vytvářet komplexní sloučeniny s ionty kovů. Toho se využívá například při odstraňování tvrdosti vody, což je hojně využíváno v pracích a mycích prostředcích (Ca2+ ionty jsou „polapeny“ chelátem a nesnižují tak účinnost mycího procesu, což se jinak děje ve velké míře). Takto chelatovaná vodní tvrdost je navíc dobře rozpustná a nedochází tak k usazování.
EDTA je také masově používáno v papírenském průmyslu při bezchlorovém bělení buničiny, kde vázáním polyvalentních iontů (zvláště Fe3+) stabilizuje peroxid používaný k bělení a výrazně tak podporuje účinnost procesu (Fe3+ jinak způsobuje katalytický rozklad peroxidů).
Oxidační vlastnosti FeIII-EDTA jsou také využívány ve fotografii, kde se používají k rozpouštění iontů stříbra. Je důležitou složkou ve fotografickém průmyslu jako okysličovadlo v barevných vývojkách. Jejích chelačních schopností se využívá i v buněčné biologii – je schopna rozrušit buněčné spoje vyžadující přítomnost iontů vápníku. V molekulární biologii se využívá jako součást řady pufrů, například TE pufru pro uchování DNA, ve kterých zajišťuje sekvestraci dvouvazebných iontů, které jsou nezbytné pro funkci DNáz, čímž brání degradaci DNA.
V medicíně se EDTA využívá při chelatační terapii, ve které slouží k odstranění těžkých kovů z těla.
Trojdraselná sůl EDTA (K3-EDTA) patří mezi základní protisrážlivé činidlo používané při odběrech krve. Vyvázáním vápníku znemožňuje srážení odebrané krve.[5]
V poslední době se stále více řeší nepříliš dobrá biologická rozložitelnost EDTA, která vede k hledání biologicky lépe rozložitelných alternativ.
Odkazy
Reference
V tomto článku byl použit překlad textu z článku EDTA na anglické Wikipedii.
- ↑ a b Edetic acid. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ https://www.sigmaaldrich.com/catalog/product/sial/e9884?lang=en®ion=US&cm_sp=Insite-_-caSrpResults_srpRecs_srpModel_mfcd00003541-_-srpRecs3-2
- ↑ https://www.sigmaaldrich.com/content/dam/sigma-aldrich/docs/Sigma/Product_Information_Sheet/e5134pis.pdf
- ↑ https://www.sigmaaldrich.com/content/dam/sigma-aldrich/docs/Sigma/Product_Information_Sheet/e6511pis.pdf
- ↑ PENKA, Miroslav; TESAŘOVÁ, Eva. Hematologie a transfuzní lékařství. I, Hematologie. 1. vyd. Praha: Grada, 2011. 421 s. ISBN 978-80-247-3459-0.
- Bezpečnostní listy k produktům Dissolvine Z (kyselina EDTA), Dissolvine NA2 (dihydrogensodná sůl EDTA), Dissolvine NA (sodná sůl EDTA) firmy AkzoNobel.
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu EDTA na Wikimedia Commons
Obrázky, zvuky či videa k tématu EDTA na Wikimedia Commons - Lanigan RS, Yamarik TA. Final report on the safety assessment of EDTA, calcium disodium EDTA, diammonium EDTA, dipotassium EDTA, disodium EDTA, TEA-EDTA, tetrasodium EDTA, tripotassium EDTA, trisodium EDTA, HEDTA, and trisodium HEDTA. Int. J. Toxicol.. 2002, roč. 21 Suppl 2, s. 95–142. DOI 10.1080/10915810290096522. PMID 12396676.
- pH-Spectrum of EDTA complexes Archivováno 15. 3. 2007 na Wayback Machine.
- EDTA: Molecule of the Month
- EDTA Determination of Total Water Hardness
- 507 references regarding oral EDTA
- EDTA: the chelating agent under environmental scrutiny, Química Nova, Nov.-Dec., 2003 (text version)
- EDTA: the chelating agent under environmental scrutiny, Química Nova, Nov.-Dec., 2003 (PDF version)
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
Structure of EDTA