Elektrocyklická reakce
Elektrocyklická reakce je druh pericyklické přesmykové reakce, při níž dojde k přeměně jedné vazby pí na vazbu sigma nebo naopak.[1] Dělí se na různé typy, a to podle následujících hledisek:
- Reakce může být fotochemická i tepelná
- Může dojít k otevření cyklu nebo k jeho vytvoření
- V závislosti na typu (fotochemická nebo tepelná) a počtu pí elektronů může reakce probíhat konrotačním nebo disrotačním mechanismem; na druhu rotace závisí, zda produkt vznikne jako cis- nebo trans-izomer.
Příklady
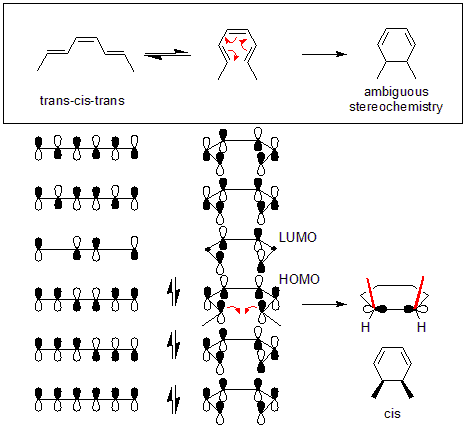
Nazarovova cyklizační reakce je elektrocyklická reakce, při níž se divinylketony přeměňují na cyklopentenony. Dalším příkladem elektrocyklické reakce je tepelné otevření cyklu 3,4-dimethylcyklobutenu. Z cis izomeru vzniká cis,trans-hexa-2,4-dien, zatímco produktem přeměny trans izomeru je trans,trans-dien.[2]
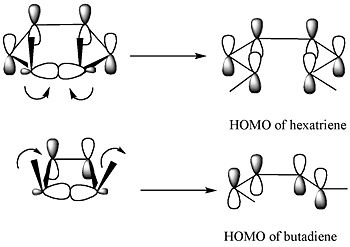
Uvedenou selektivitu reakce lze vysvětlit analýzou pomocí teorie hraničních molekulových orbitalů: vazba sigma v reaktantu se otevře takovým způsobem, aby vzniklé p orbitaly měly stejnou symetrii jako HOMO produktu.
Stereospecificita elektrocyklických reakcí
Při provádění elektrocyklických reakcí je často žádoucí možnost předvídat cis-trans geometrii produktu. Její určování začíná zjištěním, zda bude reakce probíhat konrotačně nebo disrotačně. V následující tabulce jsou shrnuta pravidla selektivity tepelných a fotochemických elektrocyklických reakcí:
| Systém | Tepelná reakce (základní stav) | Fotochemická reakce (excitování stav) |
|---|---|---|
| Sudý počet konjugovaných vazeb | Konrotační | Disrotační |
| Lichý počet konjugovaných vazeb | Disrotační | Konrotační |
U níže uvedeného příkladu probíhá tepelná reakce (trans,cis,trans)-okta-2,4,6-trienu disrotačním mechanismem. Pté lze geometrii produktu určit zkoumáním výchozí molekuly. Zde disrotace způsobuje, že se obě methylové skupiny nacházejí nahoře, což vede k cis-dimethylcyklohexadienu.
U konrotačních reakcí však může rotace probíhat ve dvou různých směrech, čímž se vytváří enantiomerní produkty.
Mechanismus tepelných reakcí
Woodwardova-Hoffmanova pravidla
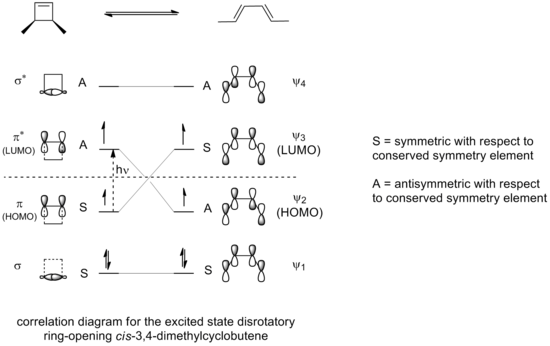
Pro každý z obou typů elektrocyklické reakce lze vytvořit korelační diagram, který spojuje molekulové orbitaly reaktantu s orbitaly produktu, které mají stejnou symetrii.[3]
Z těchto diagramů vyplývá, že symetrií je povoleno pouze konrotační otevírání cyklu 3,4-dimethylcyklobutenu a pouze disrotační otevírání 5,6-dimethylcyklohexa-1,3-dienu. Pouze v takových případech totiž v přechodném stavu dochází k maximálnímu překryvu orbitalů a produkt se vytvoří v základním stavu místo excitovaného.
Teorie hraničních molekulových orbitalů
Podle teorie hraničních molekulových orbitalů se vazba sigma v cyklu otevře takoovým způsobem, aby měly vytvořené p orbitaly stejnou symetrii jako HOMO produktu.[4]
Při přeměně 5,6-dimethylcyklohexa-1,3-dienu k tomu dojde jenom při disrotační reakci, avšak u 3,4-dimethylcyklobutenu jen tehdy, když je reakce konrotatorní.
Mechanismus fotochemických reakcí
Pokud bude otevírání cyklu 3,4-dimethylcyklobutenu řízeno fotochemicky, tak bude elektrocyklizace probíhat disrotačně, tak, jak je znázorněno na korelačním diagramu:
Pouze disrotační mechanismus zde povede k maximálnímu překryvu orbitalů. Excitovaný stav produktu tak bude podobně stabilní jako excitovaný stav výchozí látky.
Elektrocyklické reakce v organismech
K elektrocklickým reakcím často dochází i v přírodě,[5] například při biosyntéze vitaminu D3:
Prvním krokem syntézy je fotochemické konrotační otevírání cyklu 7-dehydrocholesterolu za vzniku provitaminu D3. Následným [1,7]-hydridovým posunem se vytváří vitamin D3.
Dalším případem je předpokládaná biosyntéza aranotinu, přírodního oxepinu, a podobných sloučenin:
Enzymatickou epoxidací diketopiperazinu odvozeného od fenylalaninu vzniká arenoxid, u kterého následně proběhne 6π disrotační elektrocyklická reakce za vzniku oxepinu. Po opětovné epoxidaci kruhu blízký nukleofilní dusík atakuje elektrofilní uhlík za vzniku petičlenného cyklu. Tento cyklus je běžným systémem v molekulách aranotinu a dalších látek.
Benzokaradienový diterpenoid (A) se přesmykuje na benzocykloheptatrienový isosalvipuberlin (B) při zahřívání svého roztoku v dichlormethanu. Tato přeměna zahrnuje disrotační elektrocyklickou reakci , po níž proběhnou dva suprafaciální 1,5-sigmatropní posuny vodíků.[6]
Elektrocyklické reakce v organické syntéze
Často zkoumanou elektrocyklickou reakcí je konrotační tepelné otevírání cyklu benzocyklobutenu. Produktem je velmi nestabilní ortho-chinodimethan, který ale může reagovat se silným dienofilem, například maleinanhydridem, za tvorby Dielsova–Alderova adduktu. Výtěžnost této reakce zobrazená na n závisí na vlastnoásledujícím obrázkustech substituentu R.[7] Při použití toluenu či podobné látky jako rozpouštědla a za teploty 110 °C výtěžnost roste od methylové přes isobutylmethylovou až k trimethylsilylmethylové skupině. Vyšší výtěžnost u trimethylsilylových sloučenin je možné vysvětlit hyperkonjugací, ke které dochází, protože vazba βC-Si dodáváním elektronů oslabuje vazbu C-C v cyklobutanu.
V souvislosti s izolací a syntézou některých endiandrových kyselin byla objevena biomimetická electrocyklická řetězová reakce.:[8][9]
Významnou oblastí výzkumu v organické syntéze jsou asymetrické elektrocyklické reakce. Nejčastěji se zkoumají 4π Staudingerova syntéza β laktamů[10] a 4π Nazarovovy reakce; asymetrické katalýzy obou reakcí se dosahuje využitím chirálních pomocníků, u Nazarovovy reakce se používají chirální Lewisovy kyseliny, Brønstedovy–Lowryho kyseliny a chorální aminy.[11]
Reference
V tomto článku byl použit překlad textu z článku Electrocyclic reaction na anglické Wikipedii.
- ↑ IUPAC Gold Book
- ↑ The preparation and isomerization of - and -3,4-dimethylcyclobutene. Tetrahedron Letters, Volume 6, Issue 17, 1965, Pages 1207-1212 Rudolph Ernst K. Winter DOI:10.1016/S0040-4039(01)83997-6
- ↑ The conservation of orbital symmetry. Accounts of Chemical Research, Volume 1, Issue 1, 1968, Pages 17–22 Roald Hoffmann and Robert B. Woodward DOI:10.1021/ar50001a003
- ↑ Fleming, Ian. Frontier Orbitals and Organic Chemical Reactions. 1976 (John Wiley & Sons, Ltd.) ISBN 0-471-01820-1
- ↑ Biosynthetic and Biomimetic Electrocyclizations. Chemical Reviews, Volume 105, Issue 12, 2005, Pages 4757-4778 Christopher M. Beaudry, Jeremiah P. Malerich and Dirk Trauner DOI:10.1021/cr0406110
- ↑ J. T. Arnason, Rachel Mata, John T. Romeo. Phytochemistry of Medicinal Plant(2nd Edition).1995 (Springer) ISBN 0-306-45181-6, ISBN 978-0-306-45181-2
- ↑ Accelerated Electrocyclic Ring-Opening of Benzocyclobutenes under the Influence of a -Silicon Atom Yuji Matsuya, Noriko Ohsawa, and Hideo Nemoto Journal of the American Chemical Society; 2006; 128(2) pp 412 - 413; (Communication) DOI:10.1021/ja055505+
- ↑ The endiandric acid cascade. Electrocyclizations in organic synthesis. 4. Biomimetic approach to endiandric acids A-G. Total synthesis and thermal studies K. C. Nicolaou, N. A. Petasis, R. E. Zipkin, Journal of the American Chemical Society, 1982, 104 (20), pp 5560–5562 DOI:10.1021/ja00384a080
- ↑ Inspirations, Discoveries, and Future Perspectives in Total Synthesis K. C. Nicolaou Journal of Orgaicn Chemistry, 2009 Article ASAP DOI:10.1021/jo802351b
- ↑ https://www.organic-chemistry.org/namedreactions/staudinger-synthesis.shtm
- ↑ Asymmetric electrocyclic reactions, S. Thompson, A. G. Coyne, P. C. Knipe and M. D. Smith, Chemical Society Reviews, 2011, 40, pp 4217-4231 DOI:10.1039/C1CS15022G
Média použitá na této stránce
Disrotatory
Dimethylcyclobutene ringopening mechanism
Autor: Hbf878, Licence: CC0
Biosynthesis of aranotin and related compounds. Redrawn from File:Aranotin.jpg
Autor: V8rik, Licence: CC BY-SA 3.0
Electrocyclic reaction Matsuya 2006
synthesis of isosalvipuberlin
Orbital correlation diagram for the Woodward-Hoffmann allowed photochemical ring-opening of a cyclobutene derivative
Electrocyclization In Endrianic Acid Synth
Correlation diagrams for the allowed conrotatory ring opening of 3,4-dimehtylcyclobutene and the allowed disrotatory ring opening of 5,6-dimethylcyclohexa-1,3-diene
(c) V8rik na projektu Wikipedie v jazyce angličtina, CC BY-SA 3.0
Winter dimethylcyclobutene isomerization
Symmetry Elements maintained throughout conrotatory or disrotatory processes.
Frontier Molecular Orbital Theory to explain stereospecificity of electrocyclic reactions