Embryonální kmenová buňka
| Embryonální kmenové buňky | |
|---|---|
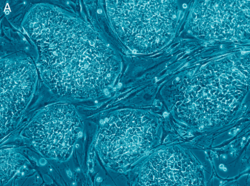
 Embryonální lidská kmenová buňka. | |
Anatomie, fyziologie buňky Video snímání lidské embryonální kmenové buňky odhalující vnitřní strukturu. | |
| Latinsky | Cellula praecursoria |
| MeSH | D053595 |

Embryonální kmenová buňka (ESC – z angl. embryonic stem cell) je pluripotentní kmenová buňka nacházející se ve vnitřní buněčné mase raného embrya ve stadiu tzv. blastocysty.[1] To, že je embryonální kmenová buňka „pluripotentní“, znamená, že se může vyvinout v jakýkoliv buněčný typ přítomný v dospělém těle. Tento proces, probíhající během zárodečného vývoje, se označuje jako buněčná diferenciace a u člověka je zodpovědný za více než 200 různých typů buněk,[2] které společně vytváří orgánové soustavy dospělého těla. ESC jsou buňky vnitřní části blastocysty v raném stádiu vývoje embrya. V průběhu vývoje, dosáhne lidský plod stádia blastocysty 4 až 5 dní po splynutí pohlavních buněk, kdy se v tomto stádiu skládá z 50 – 150 buněk. Během vývoje z embryonálních kmenových buněk vznikají tři základní zárodečné listy: ektoderm, endoderm a mesoderm. ESC se nezačleňují do extraembryonální membrány, nebo placenty.
Během embryonálního vývoje se tyto buňky neustále dělí a následně se stávají specializovanými v rámci organismu. Například určité množství ektodermu v oblasti hřbetu plodu se specializuje na "neuroektoderm", který se v budoucnu integruje a vyvine so centrální nervové soustavy (CNS) . Později ve vývoji způsobí neurulace neuroektodermu vytvoření prvotní nervové trubice (prekurzor míchy). Ve stádiu vývinu této nervové trubice přední část podstoupí intenzivní encefalizaci vedoucí k vytvoření "vzoru" základní části mozku. Za základní buňku CNS je v tomto momentu považována nervová kmenová buňka ,která je také ještě pluripotentní. Může generovat veliký rozsah různých typů neuronů, každý s unikátním genovým základem, funkčních charakteristik, morfologie. Proces generování jednotlivých neuronů z původních kmenových buněk je nazýván neurogeneze. Prominentním typem nervové kmenové buňky je radialní glie, která má distiktivní bipolární morfologii s velmi specifickými mechanismy na prodloužení a zešíření stěn nervové trubice. Sdílí některé charakteristiky glie, nejlépe zaznamenatelné začlenění bílkoviny (GFAP), která je gliální, fibrilární a poměrně kyselá na škále pH. Typ buněk radialní glie, je primární nervovou kmenovou buňkou při vývoji CNS obratlovců, a těla buněk se usadí ve ventrikulární zóně, tvořící ventrikulární systém mozkové komory. Nervové kmenové buňky mají určitou buněčnou línii (neurony, astrocyty, oligodendrocyty), omezující ostatní možné změny. Kromě CNS se poté vytvoří také periferní nervová soustava. Po proběhlém diferenciování již pro buňku není možné změnit svou určenou funkci a s ní spojené vlastnosti.
Téměř veškeré studie zabývající se embryonálními kmenovými buňkami myší (mES), nebo lidskými embryonálními kmenovými buňkami (hES) byly odvozené z rané vnitřní hmotnosti a složení buňky. Oba typy projevují esenciální charakteristiky kmenových buněk, ale potřebují velmi odlišné prostředí na udržení stavu před diferenciací. mES jsou kultivovány na vrstvě želatiny ve formě extrabuněčného matrixu (na podporu) a vyžadují přítomnost LIF (leukemia inhibitory factor) v séru. Smíchané organické chemické látky obsahující inhibitory na GSK3B a MAPK/ERK linii, nazývané 2i, se prokázaly udržovat pluripotentní potenciál v kultuře kmenových buněk. hES jsou kultivovány na živné vrstvě MEFs (embryonálních fibroblastů myší) a vyžadují přítomnost rostoucího faktoru základního fibroblastu (bFGF or FGF-2). Bez optimálních podmínek, nebo manipulace na úrovni genů, mají ESC tendenci započít rapidní diferenciaci.
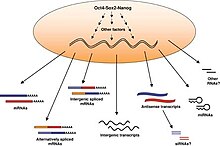
Definování lidských embryonálních kmenových buněk je také určeno povrchovými, proteiny na buňce a také expresí několika faktorů transkripce. Transkripční faktory Oct-4, Nanog, Sox2 formují základní regulační síť, zabezpečující potlačení projevu některých genů. Těch genů, které by vedly k diferenciaci a udržování aktivního pluropotentního potenciálu. Povrchové antigeny buňky na rozeznání hES jsou nejčastěji glykolipidová stádia konkrétních embryonálních antigenů 3 a 4 a KS (keratosulfate) antigeny Tra-1-60 a Tra-1-81. Využívání hES k produkci specializovaných buněk jako jsou nervové buňky a nebo také srdeční tkáně v laboratoři. Umožňuje práci s těmito typy buněk, bez nutnosti odebrání tkání pacientům. Následně mohou být tyto specializované dospělé buňky analyzovány k pochopení vzniku nemocí, nebo na nich mohou být zkoušené účinky nových typů léků. Konkrétní molekulární definice kmenových buněk je stále předmětem výzkumu. V současnosti nejsou žádné státem podporované léčby využívající ESC. První pokus na lidech byl schválen v roce 2009 americkou Food and Drug Administration.
Nicméně zkušební proces nebyl zahájen do 13. října roku 2010. Zkouška probíhala v Atlantě pro výzkum poškozené páteřní míchy. Firma řídící pozorování v listopadu 2011 (Geron Corporation) vyhlásila, že nebude nadále pokračovat ve výzkumu programu zabývajícího se kmenovými buňkami. ESC svou podstatou pluripotentní buňky vyžadují konkrétní signály na započetí správné diferenciace. Při přímé inserci do jiného těla, se ESC neřízeně rozdělí do mnoha různých typů buněk, což může způsobit teratom. Docílení diferenciace ESC za současného vyhnutí odmítnutí organismem příjemce, je stále jednou z komplikací, které výzkumníci čelí. Mnoho států má na výzkum ESC a obzvláště hES (specificky na produkci nových hES) nastavené limity a restrikce, vzhledem k přihlédnutí na etické faktory. Nicméně, vlastnosti jakými je pluripotentní potenciál a neustálá expanze a nárůst stále podtrhávají a udržují ESC jako možný zdroj pro medicínu regenerace a léčbu porušených tkání po úrazu, nebo nemoci.
Vlastnosti
Embryonální kmenové buňky se mohou diferencovat do jakéhokoliv typu buňky v plodu organismu. Vyvinutí z savčí blastocysty v raném embryonálním stádiu jim také umožňuje vlastnost propagace. Embryonální kmenové buňky mají vlastní, normální karyotyp, udržující vysokou míru aktivity telomerázy a vykazující jedinečný dlouho trvající proliferační potenciál.
Pluripotentní potenciál
ESC vnitřní masy jsou pluripotentní, jsou schopné diferenciace i v primitivní formu ektodermu, která se dále jednotlivě specializuje během gastrulace. Do všech typů tkání a vrstev odvozených z původních tří zárodečných listů ektodermu, endodermu, mesodermu. To se týká každého, z více než 200 typů buněčných specializací v dospělém těle organismu. Tento pluripotentní potenciál rozděluje ESC buňky od dospělých kmenových buněk přítomných v dospělých organismech. Zatímco ESC mohou generovat všechny typy buněk, které se v organismu původně nacházely. Dospělé kmenové buňky jsou multipotentní a mohou produkovat jen limitovaný počet typů buněk. Za předpokladu možného odebrání a zároveň uchování pluripotentního potenciálu ESC in vitro, by výsledkem mohlo být umělé laboratorní ovlivňování vývoje jednotlivých typů specializace buněk a tkání. Takové zjištění by vedlo k radikálním novým způsobům léčby širokého spektra poškození a disfunkcí způsobených stářím, nemocí, traumatem. V roce 2012 byla Nobelova cena za medicínu rozdělena mezi John B. Gurdonem a Shinya Yamanaka za objev možnosti inserce, přeprogramování dospělých stálých buněk na typ pluripotentní.
Propagace
Pod udržovanými podmínkami jsou ESC schopné vlastní propagace bez omezení v stavu, kdy ještě nejsou specializované. Udržují si svou kapacitu stále, za dodání určitých konkrétních podmínek, nastartovat rozřazování diferenciace. Podle všeho za pomocí vytváření prekurzorových buněk, téměř všech fenotypů dospělých buněk. ESC by se mohli zjednodušeně považovat za takového společného předchůdce téměř všech buněčných typů v dospělém organismu. Tyto vlastnosti ESCs dovolují jejich implementaci jako užitečného nástroje na výzkum medicíny regenerace, protože se mohou neomezeně dělit, produkovat neomezený počet generací k navazujícímu výzkumu klinického využití.
Užitečnost
Potenciální neomezená obnova, schopnost oprav a plasticita vede k navrhnutí ESC terapií pro medicínu regenerace a výměny tkání, například po popáleninách, zraněních či jiné chorobě. Mezi nemoci, které by mohly být léčeny za využití ESC, patří mnoho typů rakovin, poruch, rané cukrovky, genetických chorob a nemocí spojených s krví a imunitním systémem, ale také vývoje zubní, kostní a svalové tkáně. Díky pluripotentní vlastnosti se předpokládá i léčba Parkinsonovy nemoci, slepoty, poranění míchy. Kolem využívání ESC v terapiích s kmenovými buňkami se točí určitá kontroverze, dále je problém technického charakteru dárce-vs-příjemce, s tím spojené nemoci u alogenní transplantace kmenových buněk. Nicméně tyto problémy spojené s histokompatibilitou mohou být vyřešeny za užití odpovídajícího dárce dospělých kmenových buněk, který nebude imunitním systémem příjemce odmítnut. S je pravděpodobné využití také terapeutického klonování (therapeutic cloning). S možností přeprogramování somatických buněk definovanými faktory poskytuje spolu s ESC naději na možné překonání problémů spojených s nedostatkem darované tkáně. To tím způsobem, že se buňky nadefinují ke kompatibilitě s imunitními reakcemi příjemce. Další potenciální využití ESC leží v investigaci procesů raného vývoje člověka a také studování genetických onemocnění (například Downův syndrom) in vitro a také v toxikologických testech.

Využití a omezení
V osmdesátých letech 20. století byly vyvinuty metody získávání embryonálních kmenových buněk z myších zárodků, tyto buňky jsou následně využívány ve výzkumu. První úspěšná izolace a kultivace lidských embryonálních kmenových buněk byla provedena v roce 1998. V budoucnu by embryonální kmenové buňky mohly být použity v lékařství k opravě poškozených tkání – kmenové buňky by se diferencovaly na požadovaný buněčný typ a obnovily by funkčnost dané tkáně, např. míšní nervové tkáně či srdeční svaloviny. V současné době však stále nejsou vyřešeny problémy s možným nekontrolovaným růstem podaných kmenových buněk (tzv. teratom), navíc se experimenty s lidskými zárodky potýkají s řadou etických problémů.[1] Řešením by mohly být indukované pluripotentní kmenové buňky.
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu embryonální kmenová buňka na Wikimedia Commons
Obrázky, zvuky či videa k tématu embryonální kmenová buňka na Wikimedia Commons
Reference
- ↑ a b Stem Cells in Clinic and Research. [s.l.]: InTech, 2011. Dostupné online. ISBN 978-953-307-797-0.
- ↑ Cells of the Adult Human Body: A Catalogue [online]. Garland Science [cit. 2011-09-25]. Dostupné v archivu pořízeném dne 29-10-2010.
Média použitá na této stránce
Autor: Ziv O, Zaritsky A, Yaffe Y, Mutukula N, Edri R, Elkabetz Y, Licence: CC BY 4.0
Radial patterns of cell dynamics in non-Rosettes. Time-lapse images of HES5::eGFP (first time-lapse) and their phase construct-matched images (consecutive time-lapse) for Non-rosettes. Images were captured for over 4 hours (250 min) at 5-min intervals as described in Methods. Annotation for Non-Rosettes is shown in Fig 1B. For analysis purposes, raw data series were exported in TIF format, as GFP and Phase separately. Scale bar: 50 μm.
Autor: Grskovic, M. and Ramalho-Santos, M., The pluripotent transcriptome (October 10, 2008), StemBook, ed. The Stem Cell Research Community, StemBook, doi/10.3824/stembook.1.24.1, http://www.stembook.org., Licence: CC BY 3.0
The “core” regulators of pluripotency Oct4, Sox2 and Nanog, act in concert with other transcription and chromatin modifying factors to establish and maintain the transcriptional program of pluripotency. The accessible chromatin of ES cells may allow for increased global transcription resulting in expression of many genes, their splicing isoforms, intergenic spliced mRNAs, non-coding intergenic transcripts and antisense transcripts. The function of these novel transcripts in ES cells is not yet understood. Antisense transcripts are thought to regulate the expression of their sense counterparts, possibly by sense-anti-sense pairing and production of siRNAs. Endogenous siRNAs have been recently detected in oocytes (Tam et al., 2008; Watanabe et al., 2008), but so far they have not been described in ES cells. miRNAs however, have been shown to be expressed in ES cells and are required for their proliferation and differentiation (reviewed in (Bibikova et al., 2008)).
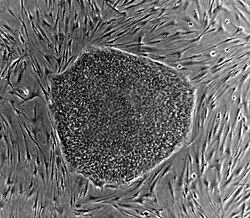
A colony of embryonic stem cells, from the H9 cell line (NIH code: WA09). Viewed at 10X with Carl Zeiss Axiovert scope.
(The cells in the background are mouse fibroblast cells. Only the colony in the centre are human embryonic stem cells)Autor:
- Human_embryonic_stem_cells.png: (Images: Nissim Benvenisty)
- derivative work: Vojtech.dostal (talk)
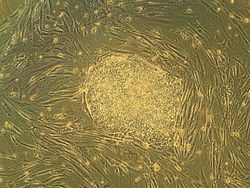
Embryonic Stem Cells. Image shows hESCs.
This image is of cell line SA02 (http://stemcells.nih.gov/research/registry/cellartis.asp). Image is of human embryonic stem (hES) cell colony on a mouse embryonic fibroblast (MEF) feeder layer.