Enaminy

Enaminy jsou nenasycené chemické sloučeniny odvozené kondenzací aldehydu nebo ketonu se sekundárnám aminem,[1] nejjednodušším jejich zástupcem je vinylamin. Slouží jako všestranné meziprodukty v organické syntéze.[2]
Název „enamin“ byl vytvořen spojením předpony -en (používané jako přípona ve slově alken) a kořene amin. Enaminy lze považovat za dusíkaté analogy enolů.
Pokud je jedním ze substituentů v molekule enaminu vodík, pak jde o tautomer iminu a často se na tento imin přeměňuje (výjimkou z tohoto pravidla je například anilin). Enaminová-iminová tautomerie je obdobou keto-enol tautomerie. V obou případech se vodíkový atom přesouvá mezi heteroatomem (kyslíkem či dusíkem) a druhým uhlíkovým atomem.
Enaminy jsou dobrými nukleofily i zásadami. Jejich charakter uhlíkatých nukleofilů se vysvětluje pomocí následujících rezonančních struktur:
Příprava
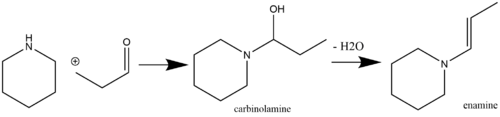
Enaminy jsou nestabilní a tedy chemicky užitečné látky, které lze snadno připravtit z komerčně dostupných výchozích látek. Běžnými způsoby přípravy jsou kysele katalyzovaná nukleofilní reakce ketonu (Stork, 1963) nebo aldehydu (Mannich/Davidsen, 1936) obsahujícího α vodík se sekundárním aminem. Kyselá katalýza není nutná, pokud je pKa reagujícího aminu dostatečně vysoká (například pyrrolidin má pKa 11,26). Pokud je pKa tohoto aminu nižší, je kyselá katalýza potřeba při adičním i dehydratačním kroku[3] (běžnými dehydratačními činidly zde jsou MgSO4 a Na2SO4).[4] Primární aminy se k synttéze enaminů obvykle nepoužívají, jelikož se při jejich použití přednostně tvoří termodynamicky stabilnější iminy.[5] Samokondenzaci methylketonů se lze vyhnout přídáním TiCl4 do reakční směsi[6] (kde zadržuje vodu)[7]. Příklad aldehydu reagujícího se sekundárním aminem za vzniku enaminu přes karbinolaminový meziprodukt je zobrazen níže:
Reakce
Alkylace
I když jsou enaminy nukleofilnější než jejich enolové protějšky, stále reagují selektivně a lze je tak použít při alkylačních reakcích. Enaminový nukleofil může atakovat halogenalkany za vzniku alkylovaných iminiových solí jako meziproduktů, které se následně hydrolyzují za vzniku ketonu. Tuto reakci objevil Gilbert Stork a někdy je po něm nazývána. Dá se použít také jako účinný způsob acylace. Lze při ní použít mnoho různých alkylačních a acylačních činidel jako jsou benzyl- a allylhalogenidy.[8]

Acylace
Enaminy mohou být, při reakci podobné alkylaci, acylovány za vzniku dikarbonylového výsledného produktu. U enaminu proběhne nukleofilní adice na acylhalogenid za vzniku meziproduktu (iminiové soli), jenž může být hydrolyzován za přítomnosti kyseliny.[5]

Metaloenaminy
Silné zásady, například LiNR2 (R jsou uhlovodíkové zbytky) je možné použít k deprotonaci iminů a tvorbě metaloenaminů. Metaloenaminy mohou být užitečné při syntéze, neboť jsou nukleofilnější než enoláty. Díky tomu lépe reagují se slabšími elektrofily (lze je například použít k otevření řetězců epoxidů[9]). Tyto reakce umožňují asymetrické alkylace ketonů pomocí jejich přeměny na chirální metaloenaminové meziprodukty.[10]
Halogenace
β-halogenimoniové sloučeniny lze syntetizovat reakcí enaminů s halogenidy v diethyletheru jako rozpouštědle. Hydrolýzou se utvoří α haloketony.[11] Je možné provést chloraci, bromaci i jodaci. Obecný průběh reakce je znázorněn zde:
Oxidační párování
Enaminy mohou být spárovány s enolsilany za přítomnosti dusičnanu amonno-ceričitého. Tyto reakce, popsané Narasakou roku 1935, představují způsob tvorby stabilních enaminů i krok při přípravě 1,4-diketonů (odvozených od morfolinových aminů).[12] Později byly tyto výsledky, společně s rozvojem organokatalyzátorů použitých u Narasakových substrátů k enantioselektivní tvorbě 1,4-dikarbonylových sloučenin doplněny McMillanovou skupinou a bylo dosaženo dobré výtěžnosti.[13] Oxidativní dimerizace aldehydů za přítomnosti aminů je často následována vznikem enaminů a nakonec vytvořením pyrrolu.[14] Tato metoda symetrické syntézy pyrrolů byla vyvinuta v roce 2010 jako nový způsob syntézy pyrrol obsahujících přírodních látek.[15]
Hajosova–Parrishova–Ederova–Sauerova–Wiechertova reakce
Hajosova–Parrishova–Ederova–Sauerova–Wiechertova reakce, popsaná roku 1971 několika výzkumnými týmy, je jedním z prvních případů enantioselektivní katalytické reakce v organické chemii. Její možnosti byly rozšířeny vývojem podobných reakcí jako jsou Michaelova adice, asymetrická aldolová reakce a Mannichova reakce. Tato reakce byla rovněž využita k provedení asymetrických Robinsonových anelací. Její obecné schéma vypadá takto:
Jde o příklad 6-enolendo aldolizace.
Významnou prolinem katalyzovanou reakcí je enantioselektivní adice acetonu nebo hydroxyacetonu na různé druhy aldehydů katalyzovaná 20-30% prolinovým katalyzátorem za vzniku diolů, jež má vysokou (>99%) výtěžnost.

Prolinem katalyzované enolexo aldolizace
Prolinem katalyzované enolexo aldolizace byly vyvinuty později než jejich enolendo protějšky. Dikarbonylové sloučeniny (dialy, diketony) mohou být přeměněny na anti-aldolové produkty s 10% L-prolinem jako katalyzátorem; tato reakce patří mezi enolexo vnitromolekulární aldolizace.[16][17]

Anulace
Chemie enaminů byla v praxi využita k vytvoření enantioselektivní verze Robinsonovy annulace. Robinsonova annulace, popsaná Robertem Robinsonem v roce 1935, je zásaditě katalyzovaná reakce, která spojuje methylvinylketon s dalším ketonem za vzniku molekuly s cyklohexenonovým cyklem. Reakce by měla být katalyzována prolinemm aby vznikaly chirální enaminové meziprodukty, což umožňuje dobrou stereoselektivitu;[18] což je důležité hlavně při syntéze přírodních látek, například Wielandova–Miescherova ketonu – součásti komplexnějších biologticky aktivních molekul.[19][20]
Reaktivita
Enaminy fungují jako nukleofily, které k reakci vyžadují méně kyselé či zásadité katalýzy než odpovídající enoláty. Mají také větší selektivitu s méně vedlejšími reakcemi. Existuje gradient reaktivity v rámci jednotlivých typů enaminů, ketonové enaminy jsou reaktivnější než jejich aldehydové protějšky.[21] Reaktivita cyklických ketonových enaminů odpovídá řadě 5>8>6>7, ty s pětičlenným cyklem jsou nejreaktivnější díky jejich nejplanárnější konformaci na dusíku, zatímco u sedmičlenných cyklů je reaktivita nejnižší.[22] [23]

Existuje několik způsobů, jak ovládat reaktivitu enaminů, patří mezi ně změna teploty, rozpouštědla, množství ostatních reaktantů a druh elektrofilu. Změnami těchto parametrů lze dosáhnout přednostní tvorby E nebo Z enaminů a také vzniku vzniku více či méně substituovaného enaminu z výchozího ketonu.
Přechodné stavy
Prolinem katalyzované aldolové reakce
Prolinem katalyzované aldolové reakce probíhají, v souladu s Zimmermanovým-Traxlerovým modelem, přes šestičlenný enaminový přechodný stav. Přidáním 20 až 30 mol% prolinu k acetonu či hydroxyacetonu se dosáhne katalýzy jejich adice na různé aldehydy s vysokou (>99%) enantioselektivitou za vzniku diolů.[24] [25] [26] Prolin a jeho deriváty se používají jako organokatalyzátory asymetrických kondenzačních reakcí. Příklad takové reakce probíhající přes šestičlenný enaminový přechodný stav je znázorněn na tomto obrázku:
Z přechodného stavu mezimolekulárních aldolizačních reakcí katalyzovaných prolinem se mohou vytvořit enolexo i enolendo produkty.

Reference
V tomto článku byl použit překlad textu z článku Enamine na anglické Wikipedii.
- ↑ Clayden, Jonathan. Organic chemistry. Oxford, Oxfordshire: Oxford University Press, 2001. Dostupné online. ISBN 0-19-850346-6.
- ↑ Enamines: Synthesis: Structure, and Reactions, Second Edition, Gilbert Cook (Editor). 1988, Marcel Dekker, NY. ISBN 0-8247-7764-6
- ↑ CAPON, Brian; WU, Zhen Ping. Comparison of the tautomerization and hydrolysis of some secondary and tertiary enamines. The Journal of Organic Chemistry. April 1990, s. 2317–2324. doi:10.1021/jo00295a017.
- ↑ LOCKNER, James. Stoichiometric Enamine Chemistry [online]. Baran Group, The Scripps Research Institute [cit. 2014-11-26]. Dostupné online.
- ↑ a b FARMER, Steven. Enamine Reactions [online]. UC Davis Chem Wiki [cit. 2014-11-26].
- ↑ CARLSON, R; NILSSON, A. Improved Titanium Tetrachloride Procedure for Enamine Synthesis. Acta Chemica Scandinavica. 1984, s. 49–53. doi:10.3891/acta.chem.scand.38b-0049.
- ↑ WHITE, William Andrew; WEINGARTEN, Harold. A versatile new enamine synthesis. The Journal of Organic Chemistry. January 1967, s. 213–214. doi:10.1021/jo01277a052.
- ↑ WADE, L.G. Organic Chemistry. Saddle River, NJ: Prentice Hall, 1999. S. 1019.
- ↑ EVANS, D. Enolates and Metalloenamines II [online]. [cit. 2014-12-10]. Dostupné online.[nedostupný zdroj]
- ↑ MEYERS, A. I.; WILLIAMS, Donald R. Asymmetric alkylation of acyclic ketones via chiral metallo enamines. Effect of kinetic vs. thermodynamic metalations.. The Journal of Organic Chemistry. August 1978, s. 3245–3247. doi:10.1021/jo00410a034.
- ↑ SEUFERT, Walter; EIFFENBERGER, Franz. Zur Halogenierung von Enaminen — Darstellung von β-Halogen-iminium-halogeniden. Chemische Berichte. 1979, s. 1670–1676. doi:10.1002/cber.19791120517.
- ↑ ITO, Y; KONOIKE, T; SAEGUSA, T. Journal of American Chemistry. 1975, s. 649–651.
- ↑ JANG, HY; HONG, JB; MCMILLAN, DW. Enantioselective organocatalytic singly occupied molecular orbital activation: the enantioselective alpha-enolation of aldehydes.. J. Am. Chem. Soc.. 2007, s. 7004–7005. doi:10.1021/ja0719428. PMID 17497866.
- ↑ LI, Q; FAN, A; LU, Z; CUI, Y; LIN, W; JIA, Y. One-pot AgOAc-mediated synthesis of polysubstituted pyrroles from primary amines and aldehydes: application to the total synthesis of purpurone. Organic Letters. 2010, s. 4066–4069. doi:10.1021/ol101644g. PMID 20734981.
- ↑ GUO, Fenghai; CLIFT, Michael D.; THOMSON, Regan J. Oxidative Coupling of Enolates, Enol Silanes, and Enamines: Methods and Natural Product Synthesis. European Journal of Organic Chemistry. September 2012, s. 4881–4896. doi:10.1002/ejoc.201200665.
- ↑ PIDATHALA, Chandarakala; HOANG, Linh; VIGNOLA, Nicola; LIST, Benjamin. Direct Catalytic Asymmetric Enolexo Aldolization. ACIE. 2003, s. 2785–2788. doi:10.1002/anie.200351266.
- ↑ MUKHERJEE, Santanu; YANG, Jung; HOFFMANN, Sebastian; LIST, Benjamin. Asymmetric Enamine Catalysis. Chem. Rev.. 2007, s. 5471–5569. doi:10.1021/cr0684016.
- ↑ LIST, Benjamin. Proline-catalyzed asymmetric reactions. Tetrahedron. 2002, s. 5573–5590. doi:10.1016/s0040-4020(02)00516-1.
- ↑ BUI, Tommy; BARBAS. A proline-catalyzed asymmetric Robinson Annulation. Tetrahedron Letters. 2000, s. 6951–6954. doi:10.1016/s0040-4039(00)01180-1.
- ↑ WIENER, Jake. Enantioselective Organic Catalysis:Non-MacMillan Approaches [online]. [cit. 2014-11-29]. Dostupné v archivu pořízeném dne 2017-10-26.
- ↑ HICKMOTT, Peter. ENAMINES: RECENT ADVANCES IN SYNTHETIC, SPECTROSCOPIC, MECHANISTIC, AND STEREOCHEMICAL ASPECTS-II. Tetrahedron. May 1982, s. 3363–3446. doi:10.1016/0040-4020(82)85027-8.
- ↑ MAYR, H. Structure-Nucleophilicity Relationships for Enamines. Chem Eur. J.. 2003, s. 2209.
- ↑ HICKMOTT, Peter. ENAMINES: RECENT ADVANCES IN SYNTHETIC, SPECTROSCOPIC, MECHANISTIC, AND STEREOCHEMICAL ASPECTS-II. Tetrahedron. May 1982, s. 3363–3446. doi:10.1016/0040-4020(82)85027-8.
- ↑ GARCIA, Jesus; OIARBIDE, Mikel; PALOMO, Claudio. Current Progress in the asymmetric aldol addition reaction. Chem. Soc. Rev.. 15 July 2005, s. 65–75. doi:10.1039/b202901d.
- ↑ NOTZ, W; LIST, B. Proline-Catalyzed Direct Asymmetric Aldol Reactions. Journal of the American Chemical Society. 2000, s. 2395. doi:10.1021/ja994280y.
- ↑ SAKTHIVEL, K.; NOTZ, W; BUI, T; BARBAS, C. Amino Acid Catalyzed Direct Asymmetric Aldol Reactions: A Bioorganic Approach to Catalytic Asymmetric Carbon−Carbon Bond-Forming Reactions. Journal of the American Chemical Society. 2000, s. 5260. doi:10.1021/ja010037z.
Externí odkazy
 Obrázky, zvuky či videa k tématu enaminy na Wikimedia Commons
Obrázky, zvuky či videa k tématu enaminy na Wikimedia Commons
Média použitá na této stránce
Autor: Akhitun, Licence: CC BY-SA 4.0
Enantioselective method for diol synthesis.
Autor: Akhitun, Licence: CC BY-SA 4.0
An enantionselective intramolecular aldol reaction.
Autor: Akhitun, Licence: CC BY-SA 4.0
Alkylation of an enamine and a dehydration to form a ketone.
Autor: Akhitun, Licence: CC BY-SA 4.0
A six-membered transition state in asymmetric proline catalysis.
Autor: Smokefoot, Licence: CC BY-SA 3.0
resonance structures describing enamines
Autor: Akhitun, Licence: CC BY-SA 4.0
Enamine synthesis with a carbinolamine intermediate.
Autor: Akhitun, Licence: CC BY-SA 4.0
The chair transition state controls, in part, whether the enolexo or the enolendo product forms.
Autor: Akhitun, Licence: CC BY-SA 4.0
Enamine nucleophile attacks acetyl chloride to form a dicarbonyl species
Autor: Akhitun, Licence: CC BY-SA 4.0
Chlorination/brominatio of enamines takes place in diethyl ether.
Autor: Akhitun, Licence: CC BY-SA 4.0
Intramolecular aldolization of a dialdehyde via an enamine intermediate.
Autor: Akhitun, Licence: CC BY-SA 4.0
Donation of the N lone pair into the C-C double bond produces a significant effect on the overall nucleophilicity of the system. Inductive effects of the ring oxygens encourage N pyramidalization which causes it to lose co-planrity with the C-C bond, eliminating that ineraction and thus reducing the nucleophilicity of that bond.