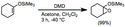Epoxidace pomocí dioxiranů
Epoxidace pomocí dioxiranů jsou chemické reakce, při nichž se vytvářejí epoxidy z alkenů pomocí cyklických peroxidů s tříčlennými cykly (dioxiran)ů.[1]
Dioxirany obsahují slabé vazby kyslík-kyslík. I když mohou oxidovat heteroatomové funkční skupiny i vazby uhlík-vodík,[2] tak se nejčastěji používají k epoxidacím alkenů. Dioxirany jsou elektrofilními oxidačními činidly, která rychleji reagují s vazbami bohatými na elektrony; v nepříliš dlouhém čase ale jimi lze epoxidovat oba druhy substrátů. Dioxirany se připravují z ketonů a hydrogenperoxosíranu draselného. In situ přípravy mohou v ketonových rozpouštědlech probíhat katalyticky, a pokud je keton chirální, tak epoxidace probíhá enantioselektivně. Spektrum funkčních skupin přijatelných při použití dioxiranů je omezené, protože se jako vedlejší reakce objevují rychle probíhající oxidace aminů a sulfidů; reakce se ale provádějí bez přítomnosti kovů. Nejčastějšími dioxiranovými epoxidačními činidly jsou dimethyldioxiran (DMD) a methyl(trifluormethyl)dioxiran (TFD).
Mechanismus a stereochemie
Mechanismus epoxidace dioxirany zahrnuje soustředěný přenos kyslíku se spirosloučeninou jako meziproduktem.[3] V průběhu tohoto přenosu je rovina dioxiranu kolmá na rovinu pí systému alkenu, kterou rozděluje na poloviny. Konfigurace alkenu se u produktu zachovává. Spiro-meziproidukt může vysvětlit selektivitu u enantioselektivních epoxidací chirálních ketonů.[4]
Stereoselektivní varianty
Diastereoselektivní epoxidace lze provézt u diastereotopmích alkenů. Při epoxidaci racemického 3-isopropylcyklohexenu vzniká jako hlavní produkt trans-epoxid, vytvořený atakem na stericky méně stíněné straně dvojné vazby.[5]
Enantioselektivní epoxidace dioxirany využívají jeden z těchto postupů: (1) oxidaci dimethyldioxiranem za přítomnosti chirálního kovového katalyzátoru a následnou epoxidaci, nebo (2) epoxidaci chirálními dioxirany, připravovanými z katalytických množství ketonů a stechiometrických množství koncových oxidantů).[4] Do prvního postupu je možné zapojit salenové komplexy manganu.[6]
Ketony pro druhý postup jsou často odvozeny od sacharidů, například Šiův katalyzátor 1 se odvozuje od fruktózy, a s vysokou enantioselektivitou epoxiduje di- i trisubstituované alkeny.[4]
Rozsah a omezení
Dioxirany pro epoxidační reakce lze připravit předem i vytvořit in situ. Při in situ epoxidacích je většinou potřeba dvoufázový systém, protože KHSO5 se nerozpouští v organických rozpouštědlech. Substráty náchylné k hydrolýze nejsou pro takovéto epoxidace vhodné.[7]
Přestože jsou dioxirany silně elektrofilní, tak mohou epoxidovat s dobrými výtěžky alkeny bohaté i chudé na elektrony (druhá skupina pouze reaguje pomaleji). Epoxidy chudé na elektrony bývají odolnější vůči hydrolýze, takže často vydrží podmínky in situ reakcí. Epoxidace dvojných vazeb bohatých na elektrony vytvářejí meziprodukty Rubottomových oxidací, ze kterých po hydrolýze vznikají α-hydroxyketony.[8]
Dvojné vazby chudé na elektrony se epoxidují déle. Oxidaci je možné usnadnit zahřátím, ale teplota reakčního prostředí by neměla překročit 50 °C, aby nedošlo k rozkladu dioxiranů.[9]
Alkeny navázané na skupiny odtahující i dodávající elektrony se chovají podobně, vyžadují dlouhé reakční doby a někdy i zahřátí. Podobně jako epoxidy chudé na elektrony mnohdy produkty jejich reakcí odolávají hydrolýze.[10]
U substrátů obsahujících více dvojných vazeb lze často na elektrony nejbohatší z nich epoxidovat selektivně.[11]
Epoxidace využívající vodné roztoky hydrogenperoxosíranu a katalytická množství ketonů lze provádět pouze s použitím určitých druhů dioxiranů (podobně jako u asymetrických reakcí) nebo v případech. kdy dioxiran nelze účinně izolovat. Produkty epoxidací se dají hydrolyzovat.[12]
Využití
Diastereoselektivní dioxiranová epoxidace chirálního nenasyceného ketonu je součástí syntézy verukosan-2β-olu.[13]
Tento druh reakce je také zahrnut do přípravy analogu glabreskolu. Posloupnost reakcí má celkovou výtěžnost 31 % a obsahuje pouze dva kroky.[14]
Srovnání s ostatními metodami
Epoxidace pomocí dioxiranů jsou široce využitelné, oproti tomu peroxokyseliny vytváří kyselé vedlejší produkty, takže substráty a produkty nemohou obsahovat skupiny citlivé na kyselé prostředí.[15] Dioxiranové epoxidace využívající izolované oxidační činidlo mohou probíhat v neutrálních prostředích a nevyžadují použití pufrů, katalytické varianty ale musí probíhat ve vodě a nejsou vhodné u substrátů obsahujících snadno hydrolyzovatelné skupiny.
Většina postupů je vhodná pro oxidace dvojných vazeb bohatých nebo chudých na elektrony, ale málokteré se dají použít u obou skupin. Weitzovy-Schefferovy podmínky (NaClO, H2O2/KOH, tBuO2H/KOH) fungují u substrátů s nedostatkem elektronů,[16] a sulfonylované oxaziridiny vykazují vysoké účinnosti u sloučenin s nadbytkem elektronů.[17]
Oxidační činidla založená na kovech jsou u katalytických reakcí často účinnější než dioxirany, vytvářejí ale vedlejší produkty škodlivé pro životní prostředí. U asymetrických postupů vykazují Sharplessova[18] i Jacobsenova epoxidace[19] lepší enantioselektivitu; toto platí i u enzymatických epoxidací, které se ale obtížně provádějí a mívají nízké výtěžky.[20]
Reakční podmínky
Dioxirany se připravují z ketonů v pufrovaných vodných roztocích KHSO5. Těkavé dioxirany se izolují destilací reakční směsi. Společně s tvorbou dioxiranu může probíhat Baeyerova–Villigerova oxidace. Po izolování se dioxirany přechovávají v ketonových roztocích a vysouší se molekulárními síty. Většina oxidací se uskutečňuje na vzduchu v Erlenmeyerových baňkách.
Oxidace s in situ připravovanými dioxirany jsou, pokud je substrát odolný vůči hydrolýze, snadněji proveditelné. Mohou probíhat v dvoufázovém prostředí za neustálého míchání, nebo v homogenních prostředích tvořených vodou a mísitelným organickým rozpouštědlem, jako je například acetonitril; asymetrické epoxidace se většinou provádějí tímto způsobem. Některé ketonové katalyzátory jsou použitelné i v mírně zásaditých prostředích.
Reference
V tomto článku byl použit překlad textu z článku Epoxidation with dioxiranes na anglické Wikipedii.
- ↑ Adam, W.; Saha-Moller, C.; Zhao, C.-G. Organic Reactions 2003, 61, 219 DOI:10.1002/0471264180.or061.02
- ↑ Adam, W.; Zhao, C.-G.; Jakka, K. Organic Reactions 2007, 69, 1
- ↑ Houk, K. N.; Liu, J.; DeMello, N. C.; Condroski, K. R. Journal of the American Chemical Society 1997, 119, 10147
- ↑ a b c Wang, Z.-X.; Tu, Y.; Frohn, M.; Zhang, J.-R.; Shi, Y. Journal of the American Chemical Society 1997, 119, 11224
- ↑ Adam, W.; Mitchell, C. M.; Saha-Möller, C. R. European Journal of Organic Chemistry 1999, 785
- ↑ Lévai, A.; Adam, W.; Fell, R. T.; Gessner, R.; Patonay, T.; Simon, A.; Tóth, G. Tetrahedron 1998, 54, 13105
- ↑ Denmark, S. E.; Wu, Z. The Journal of Organic Chemistry 1998, 63, 2810
- ↑ Adam, W.; Hadjiarapoglou, L.; Wang, X. Tetrahedron Letters 1989, 30, 6497
- ↑ Adam, W.; Hadjiarapoglou, L.; Nestler, B. Tetrahedron Letters 1990, 31, 331
- ↑ Yang, D.; Wong, M.-K.; Yip, Y.-C. The Journal of Organic Chemistry 1995, 60, 3887
- ↑ Messeguer, A.; Fusco, C.; Curci, R. Tetrahedron 1993, 49, 6299
- ↑ Denmark, S. E.; Forbes, D. C.; Hays, D. S.; DePue, J. S.; Wilde, R. G. The Journal of Organic Chemistry 1995, 60, 1391
- ↑ Piers, E.; Boulet, S. L. Tetrahedron Letters 1997, 38, 8815
- ↑ Xiong, Z.; Corey, E. J. Journal of the American Chemical Society 2000, 122, 4831
- ↑ Dryuk, V. G. Russian Chemical Reviews 1985, 54, 986
- ↑ Patai, S.; Rappoport, Z. In The Chemistry of Alkenes; Patai, S., Ed.; Wiley: New York, 1964, vol. 1, pp. 512–517
- ↑ Davis, F. A.; Sheppard, A. C.; Chen, B.-C.; Haque, M. S. Journal of the American Chemical Society 1990, 112, 6679.
- ↑ Katsuki, T.; Martin, V. S. Organic Reactions 1996, 48, 1
- ↑ Jacobsen, E. N. In Comprehensive Organometallic Chemistry II; Abel, E. W.; Stone, F. G. A.; Wilkinson, G.; Hegedus, L. S., Eds.; Pergamon: New York, 1995, Vol. 12, Chapter 11.1, pp. 1097–1135
- ↑ Adam, W.; Lazarus, M.; Saha-Möller, C. R.; Weichold, O.; Hoch, U.; Häring, D.; Schreier P. Advances in Biochemical Engineering/Biotechnology; Faber, K., Ed.; Springer Verlag: Heidelberg, 1999, vol. 63, pp. 73–108
Média použitá na této stránce
Autor: OrganicReactions, Licence: CC BY 3.0
Dioxirane epoxidation of alkenes: diastereoselective epoxidation
Autor: OrganicReactions, Licence: CC BY 3.0
Dioxirane epoxidation of alkenes: general scheme
Autor: OrganicReactions, Licence: CC BY 3.0
Dioxirane epoxidation of alkenes: double bonds with electron-donating and electron-withdrawing groups
Autor: OrganicReactions, Licence: CC BY 3.0
Dioxirane epoxidation of alkenes: site selectivity at the most electron-rich double bond
Autor: OrganicReactions, Licence: CC BY 3.0
Dioxirane epoxidation of alkenes: synthetic example
Autor: OrganicReactions, Licence: CC BY 3.0
Dioxirane epoxidation of alkenes: catalytic in ketone
Autor: OrganicReactions, Licence: CC BY 3.0
Dioxirane epoxidation of alkenes: electron-rich double bonds
Autor: OrganicReactions, Licence: CC BY 3.0
Dioxirane epoxidation of alkenes: mechanism
Autor: Dro873, Licence: CC BY-SA 3.0
Two ketones derived from carbohydrates that can be asymmetric epoxidation catalysts
Autor: OrganicReactions, Licence: CC BY 3.0
Dioxirane epoxidation of alkenes: electron-poor double bonds
Autor: OrganicReactions, Licence: CC BY 3.0
Dioxirane epoxidation of alkenes: enantioselective epoxidation via oxidation of manganese salen complexes
Autor: OrganicReactions, Licence: CC BY 3.0
dioxirane epoxidation example of stereoselective epoxidation