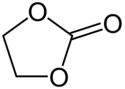
Estery kyseliny uhličité

Estery kyseliny uhličité, také nazývané karbonáty nebo organouhličitany jsou estery odvozené od kyseliny uhličité. Jejich molekuly obsahují karbonylovou skupinu spojenou s dvěma alkoxyskupinami. Obecný vzorec těchto sloučenin je R1OC(=O)OR2; jsou podobné esterům karboxylových kyselin R1OC(=O)R, etherům R1OR2 a také anorganickým uhličitanům.
Monomery polykarbonátů se do polymerních řetězců spojují přes karbonátové skupiny. Polykarbonáty se používají na výrobu kompaktních disků, neprůstřelného skla a čoček brýlí. Nižší uhličitanové estery, například dimethylkarbonát, ethylenkarbonát a propylenkarbonát, se používají jako rozpouštědla, dimethylkarbonát také jako alkylační činidlo.
Struktura

Molekuly uhličitanových esterů obsahují rovinné skupiny OC(OC)2. Vazby C=O jsou poměrně krátké (ve výše uvedeném příkladě mají délku 117,3 pm), zatímco vazby C-O jsou o něco delší (v uvedeném příkladě mají délku 132,6 pm).[1]
Podle struktury hlavního řetězce lze uhličitanové estery rozdělit do tří skupin, na acyklické, cyklické a polymerní; nejčastěji se vyskytují acyklické organouhličitany. Jsou známy uhličitanové estery s aromatickými i alifatickými substituenty.
Uhličitanové skupiny mohou být propojeny můstky tvořenými dvěma nebo třemi atomy uhlíku v cyklické molekuly, jako je ethylenkarbonát a trimethylenkarbonát. Na uhlíkový můstek mohou být navázány substituenty, například CH3 u propylenkarbonátu. Koncová alkylová nebo arylová skupina může být propojena s jinou rovněž alifatickou či aromatickou bifunkční skupinou.
Existují také polymerní karbonáty, například poly(propylenkarbonát) a poly(bisfenol A-karbonát).
Výroba a příprava
Organouhličitany se nezískávají z anorganických uhličitanů.
Jedním ze způsobů výroby je reakce alkoholu nebo fenolu s fosgenem (fosgenace), druhým reakce s oxidem uhelnatým za přítomnosti oxidačního činidla (oxidační karbonylace). Některé estery kyseliny uhličité se připravují transesterifikací.[2]
Teoreticky by bylo možné získávat estery kyseliny uhličité reakcí alkoholu s oxidem uhličitým, tento postup je ovšem termodynamicky nevýhodný.[3]
K odstraňování vody z reakční směsi a navýšení výnosnosti lze použít selektivní membránu.[4][5][6][7]
- Dimethylkarbonát, příklad acyklického esteru kyseliny uhličité
- Difenylkarbonát, další acyklický karbonát
- Ethylenkarbonát, cyklický karbonát
- Trimethylenkarbonát, další cyklický karbonát
- Poly(propylenkarbonát)
- Poly(bisfenol A-karbonát)]
Fosgenace
Alkoholy a fenoly reagují s fosgenem za vzniku esterů kyseliny uhličité podle následující obecné rovnice:
2 ROH + COCl2 → ROC(O)OR + 2 HCl
Reakce má vysokou výtěžnost; tímto způsobem se vyrábějí polykarbonáty odvozené od bisfenolu A. Používá se však při ní jedovatý fosgen a k neutralizaci vznikající kyseliny chlorovodíkové jsou nutná stechiometrická množství zásad (například pyridinu).[2] Meziprodukty zde jsou chlormravenčany, které se místo reakce s dalším ekvivalentem alkoholu disproporcionují, přičemž se tvoří požadované estery.
- C6H5OH + COCl2 → C6H5OC(O)Cl + HCl
- 2 C6H5OC(O)Cl → C6H5OC(O)OC6H5 + COCl2
Souhrnná rovnice reakce vypadá takto:
- 2 C6H5OH + COCl2 → C6H5OC(O)OC6H5 + 2 HCl
Oxidační karbonylace
Dalčí možností výroby esterů kyseliny uhličité je oxidační karbonylace. Její výhodou je, že není třeba používat fosgen. Reakce probíhá za přítomnosti katalyzátorů obsahujících měď; například dimethylkarbonát zde vzniká podle této rovnice:
- 4 CH3OH + CO + O2 → 2 CH3OC(O)OCH3 + 2 H2O
Podobně, ovšem s použitím palladnatých katalyzátorů, se také vyrábí difenylkarbonát. Při reakci je nutné použít kokatalyzátor, který zpětně zoxiduje palladium zredukované z oxidačního čísla 0 na II. Při průmyslové výrobě je katalyzátorem acetylacetonát manganitý.[8]
Reakce oxidu uhelnatého s epoxidy
Reakcí oxidu uhelnatého s epoxidy se vyrábí karbonáty obsahující pětičlenné cykly. V roce 2010 se takto vyrobilo kolem 100 000 tun cyklických karbonátů.[9] Reakcemi ethylenoxidu a propylenoxidu s oxidem uhličitým za použití vhodného katalyzátoru se poměrně snadno tvoří příslušné ethylen- a propylenkarbonáty.[2]
- C2H4O + CO2 → C2H4O2CO
Bylo zkoumáno několik katalyzátorů takových reakcí, stejně jako možnosti přípravy cyklických karbonátů bez použití epoxidů.[9]
Transesterifikace
Estery kyseliny uhličité lze přeměnit na jiné transesterifikací. Nukleofilnější alkohol přitom v molekule esteru nahrazuje méně nukleofilní, například alifatické alkoholy způsobují vytěsnění fenolů. Pokud je odcházející alkohol těkavý, tak lze rovnováhu reakce posunout destilací.[2]
Reakce močoviny s alkoholy
Dimethylkarbonát lze připravit reakcí methanolu s močovinou; vznikající amoniak lze použít znovu, jelikož zde funguje jako katalyzátor. Vedlejšími produkty jsou methyl- a N-methylkarbamát. Tento proces je oproti ostatním příliš nákladný na průmyslové využití.[10]
Použití
Estery kyseliny uhličité se používají jako polární rozpouštědla,[11] která zůstávají kapalná ve velkém rozsahu teplot, například propylenkarbonát taje při −55 °C a vře při 240 °C. Dalšími výhodami jsou nízká toxicita pro životní prostředí a dobrá biologická rozložitelnost.[12]
Estery kyseliny uhličité se jako rozpouštědla používají například v lithium-iontových akumulátorech, kde díky své značné polaritě rozpouštějí lithné soli. Vysokou viskozitu lze vyřešit například použitím směsi dimethylkarbonátu, diethylkarbonátu a dimethoxyethanu.
Cyklické karbonáty lze použít na výrobu polymerů.
Reference
V tomto článku byl použit překlad textu z článku Carbonate ester na anglické Wikipedii.
- ↑ a b Serge Perez; Raymond P. Scaringe. Crystalline features of 4,4'-isopropylidenediphenylbis(phenyl carbonate) and conformational analysis of the polycarbonate of 2,2-bis(4-hydroxyphenyl)propane. Macromolecules. 1987, s. 68–77. DOI 10.1021/ma00167a014. Bibcode 1987MaMol..20...68P.
- ↑ a b c d Abbas-Alli G. Shaikh; Swaminathan Sivaram. Organic Carbonates. Chemical Reviews. 1996, s. 951–976. DOI 10.1021/cr950067i. PMID 11848777.
- ↑ Zhi-Fang Zhang. Synthesis of Dimethyl Carbonate from Carbon Dioxide and Methanol over CexZr1-xO2and [EMIM]Br/Ce0.5Zr0.5O2. Industrial & Engineering Chemistry Research. 2011, s. 1981–1988. DOI 10.1021/ie102017j.
- ↑ Chuan-Feng Li. Study on application of membrane reactor in direct synthesis DMC from CO2 and CH3OH over Cu–KF/MgSiO catalyst. Catalysis Today. 2003, s. 83–90. DOI 10.1016/S0920-5861(03)00205-0.
- ↑ http://alexandria.tue.nl/extra1/afstversl/st/vermerris2005.pdf
- ↑ Ahmed Aouissi; Zeid Abdullah Al-Othman; Amro Al-Amro. Gas-Phase Synthesis of Dimethyl Carbonate from Methanol and Carbon Dioxide over Co1.5PW12O40 Keggin-Type Heteropolyanion. International Journal of Molecular Sciences. 2010, s. 1343–1351. DOI 10.3390/ijms11041343. PMID 20480023.
- ↑ Jun Bian. Highly effective synthesis of dimethyl carbonate from methanol and carbon dioxide using a novel copper–nickel/graphite bimetallic nanocomposite catalyst. Chemical Engineering Journal. 2009, s. 287–296. DOI 10.1016/j.cej.2008.11.006. PMID 20480023.
- ↑ Grigorii L. Soloveichik. Liquid Phase Aerobic Oxidation Catalysis: Industrial Applications and Academic Perspectives: Industrial Applications and Academic Perspectives. Příprava vydání Shannon S. Stahl, Paul L. Alsters. [s.l.]: Wiley-VCH, 2016. ISBN 9783527337811. DOI 10.1002/9783527690121.ch12. Kapitola Oxidative Carbonylation: Diphenyl Carbonate, s. 189–208.
- ↑ a b Michael North; Riccardo Pasquale; Carl Young. Synthesis of cyclic carbonates from epoxides and CO2. Green Chemistry. 2010, s. 1514. DOI 10.1039/c0gc00065e.
- ↑ [cit. 2013-10-04]. Dostupné v archivu pořízeném z originálu dne 2013-10-05.
- ↑ B. Schäffner; F. Schäffner; S. P. Verevkin; A. Börner. Organic Carbonates as Solvents in Synthesis and Catalysis. Chemical Reviews. 2010, s. 4554–4581. DOI 10.1021/cr900393d. PMID 20345182.
- ↑ Sibiya, Mike Sbonelo. Catalytic transformation of propylene carbonate into dimethyl carbonate and propylene glycol
Externí odkazy
 Obrázky, zvuky či videa k tématu Estery kyseliny uhličité na Wikimedia Commons
Obrázky, zvuky či videa k tématu Estery kyseliny uhličité na Wikimedia Commons
Média použitá na této stránce
Chemical diagram for trimethylene carbonate
Chemical structure of Lexan polycarbonate
Dimethyl_carbonate
Autor: Hbf878, Licence: CC0
Strukturni vzorec esteru kyseliny uhličité.
Autor: Smokefoot, Licence: CC BY-SA 4.0
structure of unsym dicarbonate from bis(phenol-A) and phenol
Structure of diphenyl carbonate



![Poly(bisfenol A-karbonát)]](http://upload.wikimedia.org/wikipedia/commons/thumb/6/62/Lexan.svg/120px-Lexan.svg.png)