Ethyl-acetát
| Ethyl-acetát | |
|---|---|
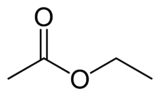 Strukturní vzorec ethyl-acetátu | |
 Model molekuly ethyl-acetátu | |
| Obecné | |
| Systematický název | ethyl-ethanoát |
| Triviální název | ethylester kyseliny octové |
| Ostatní názvy | ethyl-acetát, ethylacetát, ethylester ethanové kyseliny, ethylethanoát |
| Anglický název | Ethyl acetate |
| Německý název | Essigsäureethylester |
| Funkční vzorec | CH3COOCH2CH3 |
| Sumární vzorec | C4H8O2 |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 141-78-6 |
| EC-no (EINECS/ELINCS/NLP) | 205-500-4 |
| Indexové číslo | 607-022-00-5 |
| SMILES | CCOC(C)=O |
| Číslo RTECS | AH5425000 |
| Vlastnosti | |
| Molární hmotnost | 88,105 g/mol |
| Teplota tání | −83,6 °C |
| Teplota varu | 77,1 °C |
| Hustota | 0,897 g/cm³ |
| Dynamický viskozitní koeficient | 0,426 cP (25 °C) |
| Index lomu | 1,372 0 |
| Rozpustnost ve vodě | 8,3 g/100 ml (20 °C) |
| Struktura | |
| Dipólový moment | 1,78 D |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H225 H319 H336 EUH066 |
| R-věty | R11 R36 R66 R67 |
| S-věty | (S2) S16 S26 S33 |
| NFPA 704 | |
Některá data mohou pocházet z datové položky. | |
Ethyl-acetát nebo ethylester kyseliny octové, dříve zvaný i octan ethylnatý, je organická sloučenina s funkčním vzorcem CH3COOCH2CH3. Jedná se o ester ethanolu a kyseliny octové. Tato bezbarvá kapalina má charakteristickou sladkou vůni připomínající hrušky, ve kterých je obsažena. Vyrábí se ve velkém množství pro použití jako rozpouštědlo. V roce 1985 se v Japonsku, Severní Americe a Evropě dohromady ročně vyrobilo cca 400 tisíc tun[2], v roce 2004 se celosvětová výroba odhadovala na 1,3 milionu tun[3].
Výroba
Kyselina octová reaguje s ethanolem za vzniku ethylacetátu a vody.
- CH3COOH + CH3CH2OH ⇌ CH3COOCH2CH3 + H2O
Výsledný produkt se musí odebírat, protože reakce je rovnovážná. Lze jej odebírat například destilací.
Použití
Ethyl-acetát se primárně využívá jako rozpouštědlo a ředidlo, je upřednostňován díky nízké ceně, malé toxicitě a snesitelnému zápachu. Například se běžně používá pro čištění desek s elektronickými obvody a v některých odstraňovačích laku na nehty (používá se také aceton a acetonitril). Lze ho využít při dekofeinizaci kávových zrn a čajových lístků[4]. Používá se také v nátěrových hmotách jako aktivátor nebo tvrdidlo. Ethyl-acetát je přítomen v cukrovinkách, parfémech a v ovoci. V parfémech se rychle vypařuje a zanechává vůni parfému na kůži.
Laboratorní použití
V laboratoři se směsi obsahující ethyl-acetát často používají ve sloupcové chromatografii a při extrakcích. Málokdy se však využívá jako reakční rozpouštědlo, protože je náchylný na hydrolýzu a transesterifikaci.
V organické chemii, zejména při experimentech, ho lze odstranit stlačeným vzduchem z horké vodní lázně, protože je velmi těkavý a má nízký bod varu.
Další použití
V oblasti entomologie se ethyl-acetát využívá jako účinný asfyxant při sběru a studiu hmyzu. Ve smrtičce naplněné ethyl-acetátem jeho páry rychle usmrcují sbíraný (obvykle dospělý) hmyz, aniž by ho poškodily. Protože ethyl-acetát není hygroskopický, udržuje hmyz dostatečně měkký, aby mohl být přidán do sbírky.
Výskyt ve vínech
Ethylester kyseliny octové je nejhojnějším esterem ve víně, tvoří se reakcí kyseliny octové a ethanolu během fermentace. Aroma ethyl-acetátu je nejvíce zřejmé v mladých vínech a přispívá k obecnému vnímání "ovocnosti" vína. Citlivost různých lidí se liší, většina má práh vnímání okolo 120 mg/l. Nadměrná množství ethyl-acetátu se považují za vadu vína. Expozice kyslíku může vadu zjitřit, protože dochází k oxidaci ethanolu na acetaldehyd, který zanechává ve víně ostrou octovou chuť[5].
Reakce
Ethyl-acetát lze hydrolyzovat v kyselém nebo zásaditém prostředí a získat tak opět kyselinu octovou a ethanol. Použití kyselého katalyzátoru hydrolýzu urychluje (viz Fischerovo ekvilibrium). V laboratoři (a obvykle jen pro ilustrativní účely) se ethyl-acetát typicky hydrolyzuje ve dvoufázovém procesu, který začíná stechiometrickým množstvím silné zásady, například hydroxidu sodného. Tato reakce poskytuje ethanol a octan sodný, který s ethanolem nereaguje:
- Ethylacetát reaguje s hydroxidem sodným za vzniku ethanolu a octanu sodného.
Reaguje také s vodou:
- Ethylacetát reaguje s vodou za vzniku kyseliny octové a ethanolu.
Bezpečnost
Smrtelná dávka LD50 u potkanů činí 11,3 g/kg, což svědčí o velmi nízké toxicitě[2].
Reference
V tomto článku byl použit překlad textu z článku Ethyl acetate na anglické Wikipedii.
- ↑ a b Ethyl acetate. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ a b Wilhelm Riemenschneider, Hermann M. Bolt "Esters, Organic" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005. DOI: 10.1002/14356007.a09_565.pub2. Article Online Posting Date: April 30, 2005
- ↑ DUTIA, Pankaj. Ethyl Acetate: A Techno-Commercial Profile. Chemical Weekly. August 10th, 2004, s. 184. Dostupné online [PDF, cit. 2009-03-21]. Archivováno 21. 8. 2018 na Wayback Machine.
- ↑ Folgers.com. www.folgers.com [online]. [cit. 2009-09-03]. Dostupné v archivu pořízeném z originálu.
- ↑ J. Robinson (ed) "The Oxford Companion to Wine" Third Edition pg 259 Oxford University Press 2006 ISBN 0-19-860990-6
Externí odkazy
 Obrázky, zvuky či videa k tématu ethyl-acetát na Wikimedia Commons
Obrázky, zvuky či videa k tématu ethyl-acetát na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
Ball-and-stick model of ethyl acetate







