Fas receptor



Fas receptor (CD95, APO-1, TNFRSF6, Fas antigen) je transmembránový protein typu I z rodiny TNF receptorů (TNF - tumor nekrotizující faktor). Je exprimován na povrchu mnoha buněčných typů (zejména buněk thymu, aktivovaných T lymfocytů, hepatocytů a srdce). Lymfomy T a B buněčného původu exprimují Fas konstitutivně ve velkém množství. V imunitním systému hraje Fas receptor významnou roli. Navázáním ligandu (FasL, CD95L, CD178) spouští buněčnou smrt zvanou apoptóza, proto se mu také říká receptor smrti. Interakci Fas receptor-Fas ligand využívají cytotoxické T lymfocyty a NK buňky k zabíjení nežádoucích buněk. Fas je velmi důležitý pro periferní toleranci. Prostřednictvím Fas proteinů imunitní systém eliminuje již nepotřebné aktivované lymfocyty a autoreaktivní lymfocyty.
Gen
Gen pro Fas receptor je u člověka lokalizován na dlouhém raménku 10. chromozomu (10q24.1) a skládá se z 9 exonů. Podobné sekvence se vyskytují i u dalších savců. Např. u myši je tento gen lokalizován na 19. chromozomu a u potkana na 1. chromozomu (1q52). [1] U mnoha lidí (ale i u Drosofily) se do polypyrimidinové oblasti pre-mRNA vážou a tím regulují její sestřih tzv. intracelulární antigen T buněk (TIA-1) a proteiny mu příbuzné (TIAR). Tyto proteiny zajišťují, že exon 6 kódující transmembránový úsek je zachován a vzniká tak protein procházející přes membránu. K vystřižení exonu 6 dochází působením PTB (polypyrimidine tract binding protein) anebo Hu antigenu R (HuR). PTB a HuR jsou regulátory alternativního sestřihu pre-mRNA, jejichž aktivitou vzniká solubilní Fas.[1][2][3]
Protein
Lidský Fas receptor je polypeptid o 319 aminokyselinách, jehož molekulární hmotnost je 48 kDa. Protein patří mezi typ I membránových proteinů. Rozlišujeme tři domény: extracelulární, transmembránovou a intracelulární (cytosolickou). Extracelulární doména je tvořena 157 aminokyselinami, je kódována exony 1 až 5 a dále ji můžeme rozdělovat na 3 domény bohaté na cystein. Transmembránová doména je dlouhá 17 aminokyselin a je kódována exonem 6. Cytosolická doména je tvořena 145 aminokyselinami a je kódována exony 7 až 9. Fas receptor má více sestřihových variant, některé mohou být i v solubilní formě. (Myší Fas receptor má dvě isoformy.) [4]
Fas receptor je syntetizován v endoplazmatickém retikulu a na plazmatickou membránu je transportován Golgiho aparátem. Nádorový supresor p53 dokáže přechodně zvýšit transport Fas z cytosolických zásob na povrch buňky. Zablokováním transportu v Golgiho aparátu zastavíme možnost zvyšovat expresi Fas na membráně a zároveň inhibujeme apoptózu. p53 indukuje interakci Fas-FADD a přechodně tak zvyšuje citlivost buněk k Fas zprostředkované apoptóze.[5] Transport Fas na plazmatickou membránu negativně reguluje fosfatasa asociovaná s Fas (FAP-1).[6]
Funkce
Fas a apoptóza
Cytotoxické T lymfocyty a NK buňky využívají Fas receptorů (vedle strategie perforinů a granzymů) k likvidaci cílové buňky. (Umírá tedy buňka, jež má na svém povrchu Fas receptor.) Apoptóza je jeden z typů programované buněčné smrti. Může být iniciována několika mechanismy, které vždy končí buněčnou smrtí. Tzv. vnější dráhu indukující apoptózu zahajuje vazba Fas ligandu na Fas receptor. Po aktivaci Fas receptoru, resp. vytvořením trimeru, se začne skládat intracelulární komplex zvaný DISC (death-inducing signaling complex). Cytosolická část Fas receptoru obsahuje doménu smrti (FADD), díky níž interaguje s adaptorovým proteinem FADD. FADD rekrutuje pro-kaspasu 8 prostřednictvím homotypické interakce DED (death effector domain). [7][8][9][10][11][12]
Pro-kaspáza 8 dimerizuje, štěpením mění svou konformaci, plně se aktivuje a opouští DISC. Aktivovaná kaspáza 8 iniciuje proteolytickou kaspázovou kaskádu vedoucí k apoptóze (štěpí další pro-kaspasy a tím je aktivuje – typ signalizační dráhy I).[13] Kaspasa 8 spouští apoptózu rovněž štěpením proapoptotických molekul BID – typ signalizační dráhy II. Zkrácená forma BID je translokována do vnější membrány mitochondrií, kde probíhají děje končící buněčnou smrtí.[14],[15] Pokusy ukázaly, že kaspasou štěpený BID je nezbytný pro apoptózu iniciovanou Fas v hepatocytech a pankreatických buňkách. Zato v lymfocytech může být zcela postradatelný.[16],[17] Do intracelulárního komplexu DISC může být po aktivaci Fas receptoru začleněna i pro-kaspasa 10. (Ne však u myší - nemají gen pro kaspasu 10.) Mechanismy působení kaspasy 10 a kaspasy 8 jsou velmi podobné. Fas aktivuje transkripční faktor NFκB a indukuje produkci IL-6.[18] Apoptóza zprostředkovaná Fas receptorem nemusí být spuštěna pouze vazbou Fas ligandu, nýbrž i UV světlem. UV záření indukuje v keratinocytech tvorbu trimerů Fas receptorů stejně jako při interakci s Fas ligandem.[19] Dřívější domněnky, že také γ záření a léčba chemoterapií vyvolává apoptózu prostřednictvím Fas, nebyly potvrzeny. Apoptóza vyvolaná působením γ záření a léků využívá nádorového supresoru p53 a je regulována proteiny z Bcl-2 rodiny.[20]

Fas a aktivací indukovaná smrt T lymfocytů (AICD)
Dva na sobě nezávislé mechanismy apoptózy mají za následek smrt zralých T lymfocytů. První typ – programovaná buněčná smrt (PCD) je závislá na kostimulaci. Druhý typ – aktivací indukovaná buněčná smrt (AICD) je regulována Fas proteiny. AICD je jev, kdy T lymfocyty, které byly předtím aktivovány, podléhají apoptóze. AICD nezávisí na kostimulaci a nelze ji zvrátit růstovými ani tzv. „survival“ faktory jako jsou IL-2 a BclXL. In vivo má AICD dva významy: zaprvé snižuje imunitní odpověď eliminací již nepotřebných lymfocytů a zadruhé eliminuje autoreaktivní T buňky, které unikly selekci v thymu, tedy navozuje periferní toleranci.[21] Chronicky aktivované lidské T lymfocyty konstitutivně exprimující velká množství Fas jsou citlivá k Fas zprostředkované apoptóze. Ligace TCR/CD3 komplexu na T buňkách rychle spouští expresi Fas ligandu a neprodleně vede ke smrti buňky. Antagonisté Fas jsou schopní zablokovat AICD jako např. solubilní Fas.[22] Proč Fas transdukuje v klidových T buňkách kostimulační signály, ale apoptotické signály v dříve aktivovaných buňkách je dosud nejasné.
Fas a imunoprivilegovaná místa a transplantace
V našem těle jsou tzv. imunologicky privilegované tkáně, kde by v případě vzniku zánětu došlo k větším škodám, než při samotné infekci. Těmto destruktivním obranným mechanismům imunitního systému se vyhýbají např. pomocí mechanických bariér, nebo preferencí Th2 odpovědi ad. Jedním z mechanismů imunologicky privilegovaných tkání je konstitutivní exprese Fas ligandu. Jediné tkáně, které Fas ligand konstitutivně exprimují, jsou oko (duhovka, rohovka, sítnice) a testes (Sertoliho buňky).[23] Je známo, že transplantace imunologicky privilegovaných tkání je mnohem méně odhojována než ostatních tkání.
- Fas & neapoptotická aktivita
U většiny kultivovaných T lymfocytů je Fas receptor konstitutivně exprimován, zatímco T buňky čerstvě izolované z periferní krve rozdělujeme na základě jejich exprese Fas do dvou skupin: naivní, které exprimují Fas málo nebo vůbec, a aktivované, které exprimují relativně vysoké množství Fas. Za normálních podmínek ani jedna skupina konstitutivně neexprimuje Fas ligand. Fas ligand je rychle exprimován až po aktivaci T buněk. Čerstvě izolované T lymfocyty nepodléhají buněčné smrti zprostředkované Fas. Naopak v suboptimálních podmínkách vede ligace Fas receptoru k zvýšení proliferace a exprese IL-2 a jeho receptoru. [24],[25],[26]
Zvířecí model
Byly popsány myši se spontánní mutací Fas receptoru (lpr/lpr) a Fas ligandu (gld/gld), které vytvářejí lymfadenopatii a autoimunitní onemocnění podobné SLE (systémový lupus erythematosus). Mutace genu lpr (lymphoproliferation) patří mezi tzv. „loss-of-function“ mutace. Myši nesoucí tuto mutaci vytváří lymfadenopatii a splenomegalii, produkují autoprotilátky a trpí autoimunitními onemocněními jako je nefritida a artritida. Pacienti s autoimunitním lymfoproliferativním syndromem (ALPS) vykazují podobný fenotyp jako lpr/lpr myši a nesou mutaci Fas genu.[27]
Interakce
Fas receptor interaguje s:
- Caspase 8,[28][29][30]
- Caspase 10,[31]
- CFLAR,[29][30]
- FADD,[28][29][32][33][34][35]
- Fas ligand,[28][36][37][38]
- PDCD6,[39] and
- Small ubiquitin-related modifier 1.[40][41]
Reference
V tomto článku byl použit překlad textu z článku Fas receptor na anglické Wikipedii.
- ↑ Förch P, Puig O, Kedersha N, Martínez C. The apoptosis-promoting factor TIA-1 is a regulator of alternative pre-mRNA splicing. Mol Cell.. 2000, s. R1089-98.
- ↑ Izquierdo JM, Majós N, Bonnal S. Regulation of Fas alternative splicing by antagonistic effects of TIA-1 and PTB on exon definition. Mol Cell.. 2005, s. 475-84.
- ↑ Izquierdo JM. Hu Antigen R (HuR) Functions as an Alternative Pre-mRNA Splicing Regulator of Fas Apoptosis-promoting Receptor on Exon Definition. J Biol Chem.. 2008, s. 19077–19084.
- ↑ Itoh, N. The polypeptide encoded by the cDNA for human cell surface anti-gen Fas can mediate apoptosis. Cell.. 1991, s. 233-243.
- ↑ Bennett M, Shiu-Wan Chan K, Luzio JP. Cell Surface Trafficking of Fas: A Rapid Mechanism of p53-Mediated Apoptosis. Science. 1998, s. 290-293.
- ↑ Ivanov VN, Bergami PL, Maulit G. FAP-1 Association with Fas (Apo-1) Inhibits Fas Expression on the Cell Surface. Mol Cel Biol.. 2003, s. 3623–3635.
- ↑ Boldin, MP, Varfolomeev, EE, Pancer, Z. A novel protein that interacts with the death domain of Fas/APO1 contains a sequence motif related to the death domain. J Biol Chem.. 1995, s. 7795–7798.
- ↑ Boldin, MP, Goncharov, TM, Goltsev, YV. Involvement of MACH, a novel MORT1/FADD-interacting protease, in Fas/APO-1-and TNF receptor-induced cell death. Cell. 1996, s. 803–815.
- ↑ Chinnaiyan, AM, O’Rourke, K, Tewari, M. FADD,a novel death domain-containing protein, interacts with the death domain of Fas and initiates apoptosis. Cell. 1995, s. 505–512.
- ↑ Kischkel, FC, Hellbardt, S, Behrmann, I. Cytotoxicity-dependent APO-1 (Fas/CD95) - associated proteins form a death-inducing signaling complex (Dros. Inf. Serv.C) with the receptor. EMBO J.. 1995, s. 5579–5588.
- ↑ Muzio, M, Chinnaiyan, AM, Kischkel, FC. FLICE, a novel FADD homologous ICE/CED-3-like protease, is recruited to the CD95 (Fas/Apo-1) death-inducing signaling complex. Cell. 1996, s. 817–827.
- ↑ Irmler, M, Thome, M, Hahne, M. Inhibition of death receptor signals by cellular FLIP. Mol Cel Biol.. 1997, s. 190–194.
- ↑ Boatright, KM, Renatus, M, Scott, FL. A unified model for apical caspase activation. Mol Cell. 2003, s. 529–541.
- ↑ Li, H, Zhu, H, Xu, C.-J, and Yuan, J. Cleavage of BID by caspase 8 mediates the mitochondrial damage in the Fas pathway of apoptosis. Cell. 1998, s. 491–501.
- ↑ Luo, X, Budlhardjo, I, Zou, H. Bid, a Bcl-2 interacting protein, mediates cytochrome c release from mitochondria in response to activation of cell surface death receptors. Cell. 1998, s. 481–490.
- ↑ Kaufmann, T, Tai, L, Ekert, PG. The BH3-only protein Bid is dispensable for DNA damage- and replicative stress-induced apoptosis or cell-cycle arrest. Cell. 2007, s. 423–433.
- ↑ McKenzie, MD, Carrington, EM, Kaufmann, T. Proapoptotic BH3-only protein Bid is essential for death receptor-induced apoptosis of pancreatic beta-cells. Diabetes. 2008, s. 1284–1292.
- ↑ Rensing A, Hess S, Ziegler-Heitbrock HW. Fas/Apo-1 activates nuclear factor kappa B and induces interleukin-6 production. J Inflammation. 1995, s. 161-174.
- ↑ Aragane Y, Kulms D, Metze D. Ultraviolet Light Induces Apoptosis via Direct Activation of CD95 (Fas/APO-1) Independently of Its Ligand CD95L. JCB. 1998, s. 171–182.
- ↑ Newton K, Strasser A. Ionizing Radiation and Chemotherapeutic Drugs Induce Apoptosis in Lymphocytes in the Absence of Fas or FADD/MORT1 Signaling: Implications for Cancer Therapy. J Exp Med.. 2000, s. 195-200.
- ↑ van Parijs L, Abbas AK. The Roles of Costimulation and Fas in T Cell Apoptosis and Peripheral Tolerance. Immunity. 1996, s. 321-328.
- ↑ Alderson M, Tough TW, Davis-Smith T. MFas Ligand Mediates Activation-induced Cell Death in Human T Lymphocytes. J Exp Med.. 1995, s. 71-77.
- ↑ Suda T, Takahashi T, Golstein P. Molecular cloning and expression of the Fas ligand, a novel member of the tumor necrosis factor family. Cell. 1993, s. 1169-1178.
- ↑ Lynch DH, Ramsdell F and Alderson MH. Fas and FasL in the homeostatic regulation of immune responses. Immunology Today. 1995.
- ↑ Miyawaki, T, Uehara, T, Nibu, R. Differential expression of apoptosis-related Fas antigen on lymphocyte subpopulations in human peripheral blood. J Immunol.. 1992, s. 3753-3758.
- ↑ Klas, C, Debatin, KM, Jonker, RR and Krammer, PH. Activation interferes with the APO-1 pathway in mature human T cells. Int Immunol.. 1993, s. 625-630.
- ↑ Fisher GH et al. Dominant Interfering Fas Gene Mutations Impair Apoptosis in a Human Autoimmune Lymphoproliferative Syndrome. Cell. 1995, s. 935-946.
- ↑ a b c Gajate C, Mollinedo F. Cytoskeleton-mediated death receptor and ligand concentration in lipid rafts forms apoptosis-promoting clusters in cancer chemotherapy. J. Biol. Chem.. 2005, s. 11641–7. DOI 10.1074/jbc.M411781200. PMID 15659383.
- ↑ a b c MacFarlane M, Ahmad M, Srinivasula SM, Fernandes-Alnemri T, Cohen GM, Alnemri ES. Identification and molecular cloning of two novel receptors for the cytotoxic ligand TRAIL. J. Biol. Chem.. 1997, s. 25417–20. DOI 10.1074/jbc.272.41.25417. PMID 9325248.
- ↑ a b Shu HB, Halpin DR, Goeddel DV. Casper is a FADD- and caspase-related inducer of apoptosis. Immunity. 1997, s. 751–63. DOI 10.1016/S1074-7613(00)80450-1. PMID 9208847.
- ↑ Vincenz C, Dixit VM. Fas-associated death domain protein interleukin-1beta-converting enzyme 2 (FLICE2), an ICE/Ced-3 homologue, is proximally involved in CD95- and p55-mediated death signaling. J. Biol. Chem.. 1997, s. 6578–83. DOI 10.1074/jbc.272.10.6578. PMID 9045686.
- ↑ Pan G, O'Rourke K, Chinnaiyan AM, Gentz R, Ebner R, Ni J, Dixit VM. The receptor for the cytotoxic ligand TRAIL. Science. 1997, s. 111–3. DOI 10.1126/science.276.5309.111. PMID 9082980.
- ↑ Huang B, Eberstadt M, Olejniczak ET, Meadows RP, Fesik SW. NMR structure and mutagenesis of the Fas (APO-1/CD95) death domain. Nature. 1996, s. 638–41. DOI 10.1038/384638a0. PMID 8967952.
- ↑ Chinnaiyan AM, O'Rourke K, Tewari M, Dixit VM. FADD, a novel death domain-containing protein, interacts with the death domain of Fas and initiates apoptosis. Cell. 1995, s. 505–12. DOI 10.1016/0092-8674(95)90071-3. PMID 7538907.
- ↑ Thomas LR, Stillman DJ, Thorburn A. Regulation of Fas-associated death domain interactions by the death effector domain identified by a modified reverse two-hybrid screen. J. Biol. Chem.. 2002, s. 34343–8. DOI 10.1074/jbc.M204169200. PMID 12107169.
- ↑ Micheau O, Tschopp J. Induction of TNF receptor I-mediated apoptosis via two sequential signaling complexes. Cell. 2003, s. 181–90. DOI 10.1016/S0092-8674(03)00521-X. PMID 12887920.
- ↑ Starling GC, Bajorath J, Emswiler J, Ledbetter JA, Aruffo A, Kiener PA. Identification of amino acid residues important for ligand binding to Fas. J. Exp. Med.. 1997, s. 1487–92. DOI 10.1084/jem.185.8.1487. PMID 9126929.
- ↑ Schneider P, Bodmer JL, Holler N, Mattmann C, Scuderi P, Terskikh A, Peitsch MC, Tschopp J. Characterization of Fas (Apo-1, CD95)-Fas ligand interaction. J. Biol. Chem.. 1997, s. 18827–33. DOI 10.1074/jbc.272.30.18827. PMID 9228058.
- ↑ Jung YS, Kim KS, Kim KD, Lim JS, Kim JW, Kim E. Apoptosis-linked gene 2 binds to the death domain of Fas and dissociates from Fas during Fas-mediated apoptosis in Jurkat cells. Biochem. Biophys. Res. Commun.. 2001, s. 420–6. DOI 10.1006/bbrc.2001.5769. PMID 11606059.
- ↑ Okura T, Gong L, Kamitani T, Wada T, Okura I, Wei CF, Chang HM, Yeh ET. Protection against Fas/APO-1- and tumor necrosis factor-mediated cell death by a novel protein, sentrin. J. Immunol.. 1996, s. 4277–81. PMID 8906799.
- ↑ Ryu SW, Chae SK, Kim E. Interaction of Daxx, a Fas binding protein, with sentrin and Ubc9. Biochem. Biophys. Res. Commun.. 2000, s. 6–10. DOI 10.1006/bbrc.2000.3882. PMID 11112409.
Média použitá na této stránce
Autor: cybertory, Licence: CC BY-SA 3.0
new SVG version of old figure self-made in InkScape.
Secondary structure of Fas receptor ("death domain")
Autor: Emw, Licence: CC BY-SA 3.0
Structure of the FAS protein. Based on PyMOL rendering of PDB 1ddf.
Autor: Agathman, Licence: CC BY-SA 3.0
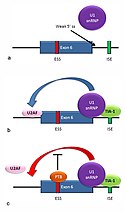
Alternative splicing of the fas apoptosis receptor.
a) The 5' splice site downstream from exon 6 in the fas pre-mRNA has a weak agreement with the consensus sequence, and is not bound usually by the U1 snRNP. b) Binding of TIA-1 protein to an intronic splicing enhancer site stabilizes binding of the U1 snRNP. The 5' donor site complex assists in binding of the splicing factor U2AF to the 3' splice site upstream of the exon. c) Binding of polypyrimidine tract binding protein (PTB) to the ure6 exonic splicing silencer in exon 6 prevents the 5' complex from assisting in U2AF binding.
In situations a and c, exon 6 is skipped, giving an mRNA encoding a soluble protein product. In situation b, exon 6 is included, and the resulting mRNA encodes the membrane-bound isoform of fas protein, which stimulates programmed cell death (apoptosis).
Izquierdo JM, Majós N, Bonnal S, et al (August 2005). "Regulation of Fas alternative splicing by antagonistic effects of TIA-1 and PTB on exon definition". Mol. Cell 19 (4): 475–84. DOI:10.1016/j.molcel.2005.06.015. PMID 16109372.