Fenolftalein
| Fenolftalein | |
|---|---|
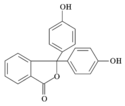
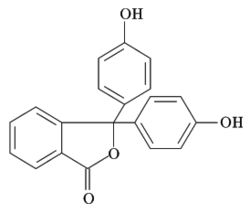 Struktura fenolftaleinu | |
| Obecné | |
| Systematický název | 3,3-bis(4-hydroxyfenyl)-2-benzofuran-1(3H)-on |
| Triviální název | fenolftalein |
| Ostatní názvy | 3,3-bis(4-hydroxyfenyl)isobenzofuran-1(3H)-on |
| Anglický název | Phenolphthalein |
| Německý název | Phenolphthalein |
| Sumární vzorec | C20H14O4 |
| Vzhled | bezbarvá pevná látka |
| Identifikace | |
| Registrační číslo CAS | 77-09-8 |
| EC-no (EINECS/ELINCS/NLP) | 201-004-7 |
| Indexové číslo | 604-076-00-1 |
| PubChem | 4764 |
| SMILES | O=C1OC(c2ccccc12)(c3ccc(O)cc3)c4ccc(O)cc4 |
| InChI | 1S/C20H14O4/c21-15-9-5-13(6-10-15)20(14-7-11-16(22) 12-8-14)18-4-2-1-3-17(18)19(23)24-20/h1-12,21-22H |
| Vlastnosti | |
| Molární hmotnost | 318,323 g/mol |
| Teplota tání | 262,5 °C |
| Hustota | 1,277 g/cm3 (32 °C) |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H350 H341 H361f |
| R-věty | R45 R62 R68 |
| S-věty | S53 S45 |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
Fenolftalein je organická aromatická sloučenina. Často se používá při acidobazických titracích jako indikátor.
Výroba
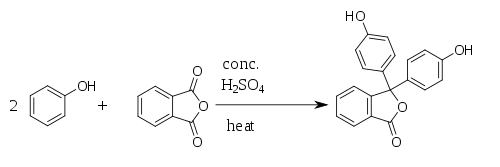
Fenolftalein byl poprvé připraven roku 1871 německým chemikem Adolfem von Baeyerem reakcí fenolu s ftalanhydridem, z čehož pochází název fenolftalein. Reakce probíhá za katalýzy kyseliny sírové a za tepla (nesmí dojít k přehřátí, protože by se rozpadal ftalanhydrid). Při reakci vzniká jako vedlejší produkt voda.
Titrace
Při acidobazických titracích se využívá barevného přechodu fenolftaleinu při změně pH. V kyselém prostředí je fenolftalein bezbarvý, v bazickém prostředí se zbarví fialově. K přechodu dochází při pH 8,2-9,8. Fenolftalein se používá ve formě roztoku v ethanolu.
| Sloučenina | H3In+ | H2In | In2− | In(OH)3− |
|---|---|---|---|---|
| Struktura |  |  |  |  |
| Model |  |  |  |  |
| pH | < 0 | 0 až 8,2 | 8,2 až 12,0 | > 12,0 |
| Prostředí | silně kyselé | kyselé až slabě zásadité | zásadité | silně zásadité |
| Barva | oranžová | bezbarvá | růžová až fialová | bezbarvá |
| Obrázek |  |  |
Užití
Fenolftalein se používá jako projímadlo. V současné době se od jeho použití ustupuje z důvodu možné karcinogenity.
Fenolftalein společně s peroxidem vodíku se používá při testování přítomnosti krve v Kastleho-Meyerově testu.
Další použití nachází při výrobě hraček, například mizejících inkoustů. Inkoust je smíchán s hydroxidem sodným, který reaguje se vzdušným oxidem uhličitým. Při reakci vzniká uhličitan sodný a klesá pH inkoustu. Pokles pH způsobí přechod fenolftaleinu z fialové do bezbarvé formy.
Reference
V tomto článku byl použit překlad textu z článku Phenolphtalein na anglické Wikipedii.
- ↑ a b Phenolphthalein. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu fenolftalein na Wikimedia Commons
Obrázky, zvuky či videa k tématu fenolftalein na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for substances hazardous to human health.
Phenolphthalein in alkaline solution (pH 9), exhibiting a pink colour
Formula of phenolphthalein at very low pH
Ball-and-stick model of the phenolphthalein molecule at very low pH (pH < 0)
Phenolphthalein synthesis
Phenolphthalein
Phenolphtalein, structure formula drawn by --Paginazero 19:38, Dic 14, 2004 (UTC) on Wikisophia corresponds to the code
<chem> \nonaheterov[dfh]{2==O}{1D==O;3Sa==\bzdrh{1==(yl);4==OH};3Sb==\bzdrv{4==(yl);1==OH}} </chem>