Fenylhydroxylamin
| Fenylhydroxylamin | |
|---|---|
 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | N-fenylhydroxylamin |
| Ostatní názvy | N-hydroxyanilin |
| Funkční vzorec | C6H5NHOH |
| Sumární vzorec | C6H7NO |
| Vzhled | hnědé krystaly[1] |
| Identifikace | |
| Registrační číslo CAS | 100-65-2 |
| EC-no (EINECS/ELINCS/NLP) | 209-711-2 |
| PubChem | 7518 |
| SMILES | ONC1=CC=CC=C1 |
| InChI | 1/C6H7NO/c8-7-6-4-2-1-3-5-6/h1-5,7-8H |
| Vlastnosti | |
| Molární hmotnost | 109,13 g/mol |
| Teplota tání | 83,5 °C (356,6 K)[1] |
| Rozpustnost ve vodě | rozpustný v horké vodě[1] |
| Rozpustnost v polárních rozpouštědlech | rozpustný v ethanolu, chloroformu a kyselině octové[1] |
| Rozpustnost v nepolárních rozpouštědlech | sirouhlíku, diethyletheru a benzenu |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H301[1] |
| P-věty | P264 P270 P301+310 P321 P330 P405 P501[1] |
Některá data mohou pocházet z datové položky. | |
Fenylhydroxylamin, také nazývaný N-hydroxyanilin, je organická sloučenina patřící mezi aromatické aminy. Je přechodnou sloučeninou mezi anilinem a nitrosobenzenem.
Příprava
Fenylhydroxylamin je možné připravit redukcí nitrobenzenu zinkem za přítomnosti chloridu amonného.[2][3]
Dalším způsobem je hydrogenace nitrobenzenu za přítomnosti hydrazinu jako zdroje vodíku a katalýzy rhodiem.[4]
Reakce
Fenylhydroxylamin se rozkládá při zahřívání a za přítomnosti silných kyselin u něj probíhá Bambergerův přesmyk na 4-aminofenol. Oxidací fenylhydroxylaminu dichromany se tvoří nitrosobenzen.
Tato látka reaguje s benzaldehydem na difenylnitron, který má 1,3-dipolární molekulu.[5]
C6H5NHOH + C6H5CHO → C6H5N(O)=CHC6H5 + H2O

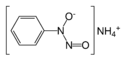
Fenylhydroxylamin reaguje se zdroji nitrosoniového kationtu za vzniku kupferronu.[6]
- C6H5NHOH + C4H9ONO + NH3 → NH4[C6H5N(O)NO] + C4H9OH
Odkazy
Externí odkazy
 Obrázky, zvuky či videa k tématu Fenylhydroxylamin na Wikimedia Commons
Obrázky, zvuky či videa k tématu Fenylhydroxylamin na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku Phenylhydroxylamine na anglické Wikipedii.
- ↑ a b c d e f g h N-Phenylhydroxylamine. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ E. Bamberger “Ueber das Phenylhydroxylamin” Chemische Berichte, volume 27 1548-1557 (1894). E. Bamberger, "Ueber die Reduction der Nitroverbindungen" Chemische Berichte, volume 27 1347-1350 (1894) (first report)
- ↑ O. Kamm. Phenylhydroxylamine. Organic Syntheses. 1941, s. 57. DOI 10.15227/orgsyn.004.0057.
- ↑ P. W. Oxley; B. M. Adger; M. J. Sasse; M. A. Forth. N-Acetyl-N-Phenylhydroxylamine via Catalytic Transfer Hydrogenation of Nitrobenzene using Hydrazine and Rhodium on Carbon. Organic Syntheses. 1989, s. 187. DOI 10.15227/orgsyn.067.0187.
- ↑ I. Brüning; R. Grashey; H. Hauck; R. Huisgen; H. Seidl. 2,3,5-Triphenylisoxazolidine. Organic Syntheses. 1966, s. 127. DOI 10.15227/orgsyn.046.0127.
- ↑ C. S. Marvel. Cupferron. Organic Syntheses. 1925, s. 19.
Média použitá na této stránce
Autor: Jynto (talk), Licence: CC0
Ball-and-stick model of the phenylhydroxylamine molecule.
Colour code:
- Carbon, C: black
- Hydrogen, H: white
- Oxygen, O: red
- Nitrogen, N: blue
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for toxic substances