Flavinadenindinukleotid
| Flavinadenindinukleotid | |
|---|---|
 | |
| Obecné | |
| Systematický název | Flavinadenindinukleotid |
| Sumární vzorec | C27H33N9O15P2 |
| Identifikace | |
| Registrační číslo CAS | 146-14-5 |
| Vlastnosti | |
| Molární hmotnost | 785,55 g/mol |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | |
| Některá data mohou pocházet z datové položky. | |
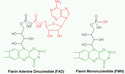
Flavinadenindinukleotid (FAD či FADH2, riboflavinadenosindifosfát) je koenzym nebo také prostetická skupina obsahující vitamín B2 (riboflavin) navázaný na adenosindifosfát (ADP). Celá molekula tedy obsahuje riboflavinovou skupinu, dva fosfáty, cukr ribózu a adenin. Od příbuzné sloučeniny flavinmononukleotidu (FMN) se liší přítomností adenosinmonofosfátu (AMP).
Jako oxidačně-redoxně aktivní sloučenina je řazena mezi flavinové nukleotidy a je součástí mnoha proteinů - flavoproteinů. Je vázaná na mnoho enzymů, včetně ferredoxin-NADP+ reduktázy, monoaminooxidázy, D-aminokyselinoxidázy, glukózoxidázy, xanthinoxidázy a acyl CoA dehydrogenázy.
V roce 1937 obdržel Paul Karrer Nobelovu cenu za svou základní práci o skupině flavinů.
Chemické složení
Všechny flavinové koenzymy se odvozují od riboflavinu. Po fosforylaci riboflavinu se získá riboflavin-5‘-fosfát, který se označuje jako flavinmononukleotid (FMN). Přidáním adenosinmonofosfátu (AMP) vzniká FAD.
Celá molekula FAD tedy obsahuje riboflavinovou skupinu, dva fosfáty, cukr ribózu a adenin.
Riboflavin
FMN
FAD
Srovnání FMN a FAD
Čtyři redoxní stavy

FAD může existovat ve čtyřech redoxních stavech, kterými jsou:[1]
- FAD - flavin-N(5)-oxid (plně oxidovaná forma)
- FAD - chinon (chinonová forma)
- FADH - semichinon
- FADH2 - hydrochinon
Mezi těmito stavy dochází k přijímání nebo darování elektronů v isoalloxazinovém systému FAD. Oxidovaná forma FAD (flavin-N(5)-oxid, chinon) přijímá dva elektrony a dva protony, mění se tak na redukovanou formu FADH2 (hydrochinon). FADH (semichinon) může být vytvořen buď redukcí FAD nebo oxidací FADH2 přijetím nebo darováním jednoho elektronu a jednoho protonu. Některé proteiny však vytvářejí a udržují plně oxidovanou formu flavinového kofaktoru, flavin-N(5)-oxidu.
Funkce v organismu
Redukovaná forma FADH2 vzniká zejména v Krebsově cyklu při dehydrogenaci sukcinátu na fumarát. FADH2 je schopen přenášet elektrony a vodíkové atomy z Krebsova cyklu do elektronového transportního řetězce (dýchací řetězec), na jehož konci se uskutečňuje syntéza ATP.[2] Je tak důležitým nosičem elektronů v různých prokaryotických a eukaryotických metabolických procesech (oxidační fosforylace, β oxidace mastných kyselin a další redoxní reakce). Na rozdíl od NAD+ může FAD přenášet jednotlivé elektrony. Oxidoreduktázy tak mohou aktivovat molekulární kyslík pomocí FAD.
Příklady enzymů, které používají FAD:
- Monoaminooxidáza
- Ferredoxin-NADP+ reduktáza
- Glukózooxidáza (GOx)
- Dehydrogenáza celoobiózy
- Nitrátreduktáza
- Sukcinátdehydrogenáza
- Dihydrolipoyldehydrogenáza
- Acyl-CoA dehydrogenáza
- D-aminokyselinoxidáza
- xanthinoxidáza
Klinický význam
Přibližně 60% lidských flavoproteinů způsobuje onemocnění při mutaci. V některých případech je to způsobeno sníženou afinitou k FAD nebo FMN. Vysoký příjem riboflavinu (vitamín B2) může zmírnit příznaky onemocnění. Kromě toho může samotný nedostatek riboflavinu a výsledný nedostatek FAD a FMN způsobit další zdravotní problémy (vývojové nebo gastrointestinální abnormality, vadný rozpad tuku, anémie, neurologické problémy, rakovina, srdeční onemocnění, migrény, zhoršené vidění a kožní léze).
Farmaceutický průmysl proto vyrábí riboflavin jako doplněk stravy. V roce 2008 byla celosvětová potřeba riboflavinu 6 000 tun ročně s výrobní kapacitou 10 000 tun. Tento trh v hodnotě 150 až 500 milionů dolarů není určen pouze pro lékařské aplikace, ale používá se také jako doplněk k výživě zvířat v zemědělském průmyslu a jako potravinářské barvivo.
FAD patří mezi řadu molekul v těle, které mají nativní fluorescenci (například také tryptofan, kolagen, NADH a porfyriny). Lékaři proto používají jejich fluorescenční vlastnosti k diagnostice a sledování léčby, která je šetrnější než standardní biopsie.
Reference
V tomto článku byly použity překlady textů z článků Flavin-Adenin-Dinukleotid na německé Wikipedii a Flavin adenine dinucleotide na anglické Wikipedii.
- ↑ Stenesh, J. (1989): Dictionary of Biochemistry and Molecular Biology (2nd Edition). John Wiley & Sons.
- ↑ ALBERTS, Bruce, et al. Essential Cell Biology. 2. vyd. New York: Garland Science, 2004. Dostupné online.
Související články
- Flavinmononukleotid (FMN)
Externí odkazy
 Obrázky, zvuky či videa k tématu flavinadenindinukleotid na Wikimedia Commons
Obrázky, zvuky či videa k tématu flavinadenindinukleotid na Wikimedia Commons
Média použitá na této stránce
Chemical structure of flavin mononucleotide created with ChemDraw.
Chemical structure of flavin adenine dinucleotide created with ChemDraw.
Structure of riboflavin