Fluoren
| Fluoren | |
|---|---|
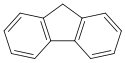
 Strukturní vzorec | |
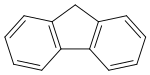
 Tyčinkový model molekuly | |
 Kalotový model molekuly | |
| Obecné | |
| Systematický název | 9H-fluoren |
| Ostatní názvy | tricyklo[7.4.0.02,7]trideka-2,4,6,9,11,13-hexaen |
| Sumární vzorec | C13H10 |
| Vzhled | bílé krystaly |
| Identifikace | |
| Registrační číslo CAS | 86-73-7 |
| EC-no (EINECS/ELINCS/NLP) | 201-695-5 |
| PubChem | 6853 |
| ChEBI | 28266 |
| SMILES | c1ccc2c3ccccc3Cc2c1 |
| InChI | 1S/C13H10/c1-3-7-12-10(5-1)9-11-6-2-4-8-13(11)12/h1-8H,9H2 |
| Číslo RTECS | LL5670000 |
| Vlastnosti | |
| Molární hmotnost | 166,22 g/mol |
| Teplota tání | 116 až 117 °C (389 až 390 K) |
| Teplota varu | 295 °C (568 K) |
| Hustota | 1,202 g/cm3 |
| Disociační konstanta pKa | 22,6 (v dimethylsulfoxidu) |
| Rozpustnost ve vodě | 1,992×10−4 g/100 ml |
| Měrná magnetická susceptibilita | −6,648×10−7 cm3g−1 |
| Bezpečnost | |
| [1] Varování[1] | |
| Teplota vzplanutí | 152 °C (425 K) |
Některá data mohou pocházet z datové položky. | |
Fluoren (též 9H-fluoren) je polycyklický aromatický uhlovodík se sumárním vzorcem C13H10, jehož molekula je formálně tvořena cyklopentanovým cyklem kondenzovaným s dvěma benzenovými jádry. Tato látka vytváří bílé krystaly s charakteristickým zápachem podobným jako u naftalenu, které jsou téměř nerozpustné ve vodě i mnoha organických rozpouštědlech.
Název tohoto uhlovodíku odráží jeho schopnost fialově fluoreskovat.
Pro komerční účely se fluoren získává z uhelného dehtu.
Příprava, struktura reaktivita
I když lze fluoren získat z uhelného dehtu, tak může být také vytvořen dehydrogenací difenylmethanu.[2] Rovněž jej lze připravit redukcí fluorenonu pomocí zinku.[3] Molekula fluorenu je téměř rovinná,[4] ovšem každý ze dvou benzenových kruhů je koplanární vzhledem k uhlíku 9 na prostředním cyklu.[5]
Kyselost
Uhlík na pozici 9 (C9) je slabě kyselý (pKa v dimethylsulfoxidu je 22,6[6] Deprotonací na tomto uhlíku vzniká fluorenylový anion C13H9−, který je aromatický a má výrazné oranžové zabarvení. Tento anion je nukleofilní a většina elektrofilů s ním reaguje tak, že se připojí na pozici 9. Při přečišťování fluorenu se využívá jeho kyselost a nízká rozpustnost sodíkového derivátu v uhlovodíkových rozpouštědlech.
Z C9 mohou být odtrženy oba protony; například lze získat 9,9-fluorenyldidraslík reakcí fluorenu s kovovým draslíkem ve vroucím dioxanu.[7]
Použití fluorenu jako ligandu
Fluoren a jeho deriváty mohou být deprotonovány za vzniku ligandů podobným cyklopentadienidům.

Použití
Fluoren je prekurzorem dalších fluorenových sloučenin a samotný nemá mnoho využití. Fluoren-9-karboxylová kyselina je výchozí látkou při výrobě některých léčiv. Oxidací fluorenu vzniká fluorenon, který je následně nitrován za vzniku řady užitečných derivátů. Fluorenylmethyloxykarbonylchlorid se používá k zavedení 9-fluorenylmethyl-karbamátové skupiny do aminů při syntéze peptidů.[2]
Polyfluorenové polymery (v nichž je C7 jedné molekuly fluorenu spojen s C2 další molekuly za odštěpení dvou vodíkových atomů) vedou elektrický proud a jsou elektroluminiscentní, díky čemuž je často zkoumáno jejich možné použití při výrobě luminoforů v organických světelných diodách.
Fluorenová barviva
Existuje několik fluorenových barviv, většina se jich vyrábí kondenzací aktivní methylenové skupiny s karbonylovými sloučeninami. K prekurzorům těchto barviv patří 2-aminofluoren, 3,6-bis(dimethylamino)fluoren a 2,7-dijodfluoren.[9]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Fluorene na anglické Wikipedii.
- ↑ a b Fluorene. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ a b Karl Griesbaum, Arno Behr, Dieter Biedenkapp, Heinz-Werner Voges, Dorothea Garbe, Christian Paetz, Gerd Collin, Dieter Mayer, Hartmut Höke „Hydrocarbons“ in Ullmann's Encyclopedia of Industrial Chemistry 2002 Wiley-VCH, Weinheim. DOI:10.1002/14356007.a13_227
- ↑ Fittig, Rud. (1873), „Ueber einen neuen Kohlenwasserstoff aus dem Diphenylenketon“ Ber. Dtsch. Chem. Ges. volume 6, p. 187.DOI:10.1002/cber.18730060169
- ↑ D. M. Burns, John Iball (1954), Molecular Structure of Fluorene Nature volume 173, p. 635. DOI:10.1038/173635a0
- ↑ R. E. Gerkin, A. P. Lundstedt and W. J. Reppart (1984) Structure of fluorene, C13H10, at 159 K Acta Crystallographica, volume C40, pp. 1892–1894 DOI:10.1107/S0108270184009963
- ↑ F. G. Bordwell. Equilibrium acidities in dimethyl sulfoxide solution. Accounts of Chemical Research. 1988, s. 456–463. (anglicky)
- ↑ G. W. Scherf; R. K. Brown. Potassium Derivatives of Fluorene as Intermediates in the Preparation of C9-substituted Fluorenes. I. The Preparation of 9-fluorenyl Potassium and the Infrared Spectra of Fluorene and Some C9-substituted Fluorenes. Canadian Journal of Chemistry. 1960, s. 697. (anglicky)
- ↑ J. A. Ewen; R. L. Jones; A. Razavi; J.D. Ferrara. Syndiospecific Propylene Polymerizations with Group IVB Metallocenes. Journal of the American Chemical Society. 1988, s. 6255–6256. (anglicky)
- ↑ I. V. Kurdyukova; A. A. Ishchenko. Organic dyes based on fluorene and its derivatives. Russian Chemical Reviews. 2012, s. 258–290. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu Fluoren na Wikimedia Commons
Obrázky, zvuky či videa k tématu Fluoren na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Structural formula of fluorene
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
Ball-and-stick model of the fluorene molecule, C13H10, as found in the crystal structure
X-ray crystallographic data from Acta Cryst. (1984). C40, 1210-1211.
Model constructed in CrystalMaker 8.1.
Image generated in Accelrys DS Visualizer.Space-filling model of the fluorene molecule, C13H10