Fluorid antimoničný
| Fluorid antimoničný | |
|---|---|
 | |
 | |
| Obecné | |
| Systematický název | Fluorid antimoničný |
| Anglický název | Antimony pentafluoride |
| Německý název | Antimon(V)-fluorid |
| Sumární vzorec | SbF5 |
| Vzhled | Bezbarvá viskózní kapalina |
| Identifikace | |
| Registrační číslo CAS | 7783-70-2 |
| Vlastnosti | |
| Molární hmotnost | 216,74 g/mol |
| Teplota tání | 8,3 °C |
| Teplota varu | 149,5 °C |
| Hustota | 2,997 g/m3 (23 °C) |
| Rozpustnost ve vodě | reaguje |
| Rozpustnost v polárních rozpouštědlech | rozpouští se v kapalném SO2 a SO2FCl |
| Tlak páry | 13 hPa (25 °C) |
| Termodynamické vlastnosti | |
| Entalpie varu ΔHv | 200,2 J/g |
| Měrné teplo | 0,496 J.kg−1.K−1 (konst. tlak, 25 °C, plyn) |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R20/22, R51/53 |
| S-věty | S2, S61 |
| NFPA 704 | |
Některá data mohou pocházet z datové položky. | |
Fluorid antimoničný je sloučeninou antimonu a fluoru, jeho chemický vzorec je SbF5. Za normálních podmínek to je bezbarvá kapalina. Má velmi silné korozivní účinky a je toxický. S vodou reaguje za vzniku plynného fluorovodíku.
Fluorid antimoničný je součástí kyseliny fluoroantimoničné, která je nejsilnější známou kyselinou o 100% koncentraci.[2]
Příprava
Fluorid antimoničný lze připravit reakcí chloridu antimoničného s bezvodým fluorovodíkem:[3][4]
- SbCl5 + 5 HF → SbF5 + 5 HCl
Další možnou přípravou je reakce fluoridu antimonitého s fluorem.[4][5]
- SbF3 + F2 → SbF5
Struktura
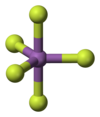
V plynném stavu je fluorid antimoničný monomerní, molekula má tvar trigonální bipyramidy, grupa symetrie D3h. V pevném stavu vytváří cyklické tetramerní molekuly {SbF5}4, tvořené oktaedry SbF6 propojenými vrcholy.[4][6]
Odkazy
Reference
- ↑ a b Antimony pentafluoride. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ Olah, G. A. A Life of Magic Chemistry: Autobiographical Reflections of a Nobel Prize Winner. [s.l.]: John Wiley and Sons, 2001. ISBN 0-471-15743-0. S. 100–101. (anglicky)
- ↑ GRUND, Sabina C.; HANUSCH, Kunibert; BREUNIG, Hans J. Antimony and Antimony Compounds. Příprava vydání Wiley-VCH Verlag GmbH & Co. KGaA. Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA Dostupné online. ISBN 9783527306732. DOI 10.1002/14356007.a03_055.pub2. (anglicky) DOI: 10.1002/14356007.a03_055.pub2.
- ↑ a b c HOUSECROFT, Catherine; SHARPE, Alan. Anorganická chemie. 1. vyd. Praha: VŠCHT, 2014. 1119 s. ISBN 978-0273-74275-3. S. 501.
- ↑ BRAUER, GEORG. Handbook of Preparative Inorganic Chemistry V2.. 2. vyd. Burlington: Elsevier Science 1 online resource (882 pages) s. ISBN 9780323161299, ISBN 0323161294. OCLC 843200097 S. 200.
- ↑ EDWARDS, A. J.; TAYLOR, P. Crystal structure of antimony pentafluoride. Journal of the Chemical Society D: Chemical Communications. 1971, čís. 21, s. 1376. Dostupné online [cit. 2023-11-17]. ISSN 0577-6171. DOI 10.1039/c29710001376. (anglicky)
Literatura
- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Externí odkazy
 Obrázky, zvuky či videa k tématu Fluorid antimoničný na Wikimedia Commons
Obrázky, zvuky či videa k tématu Fluorid antimoničný na Wikimedia Commons
Média použitá na této stránce
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for hazardous substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.









